Stammzellen in der regenerativen Medizin
Autorin:
Univ.-Prof. i. R. Dr. Hildegard Greinix
Department für Innere Medizin I/KMT
Medizinische Universität Wien
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Unbegrenzte Selbsterneuerung sowie die Möglichkeit der Differenzierung in reifere Gewebe und Zellen zeichnen Stammzellen aus, wobei sich diese je nach Entwicklungspotenzial nur in Zellen der Gewebe entwickeln können, in denen sie sich befinden, oder sich auch in andere Gewebe transdifferenzieren können.
Keypoints
-
Adulte Stammzellen regenerieren stark beanspruchte Körpergewebe lebenslang.
-
Mesenchymale Stromazellen könnten einen hohenStellenwert bei der Hautregeneration haben.
-
Exosomen regulieren die Proliferation, Differenzierung, Migration, Apoptose und interzelluläre Kommunikation der Zellen und könnten für die Wundheilung und Verhinderung von exzessiver Narbenbildung wichtig sein.
-
Stammzellen sind als „lebende Medikamente“ anzusehen und können nach In-vivo-Verabreichung unterschiedliche Wirkungen erzielen.
Während sich pluripotente Stammzellen zu unterschiedlichen Organen entwickeln können, sind adulte Stammzellen multipotent und bereits auf ein Organ festgelegt. Adulte Stammzellen regenerieren stark beanspruchte Körpergewebe wie Haare, Haut, Muskel, Knochen, Knorpel und Schleimhäute lebenslang.
Auch wenn bei vielen unterschiedlichen Erkrankungen Stammzelltherapien versucht wurden, ist ein wissenschaftlich nachgewiesener klinischer Benefit bisher nur für die Anwendung hämatopoetischer Stammzellen im Rahmen der Blutstammzelltransplantation (HSZT) als kurative Therapie von Patienten mit akuten Leukämien, Lymphomen und Myelomen sowie bei der Gabe von Stammzellen zur Regeneration der Haut nach schweren Verbrennungen und Regeneration der Cornea durch die Verabreichung entsprechender Stammzellen dokumentiert. Gute Ergebnisse wurden bei Autoimmunerkrankungen wie der systemischen Sklerose oder dem systemischen Lupus erythematodes nach Hochdosisimmunsuppression und Verabreichung hämatopoetischer Stammzellen erzielt, während bei vielen anderen Erkrankungen einschließlich Verbesserung der Wundheilung sehr fragwürdige Ergebnisse vorliegen.
Ablauf der Wundheilung und Möglichkeiten ihrer Beeinflussung
Die Haut setzt sich aus Dermis und Epidermis zusammen und enthält wie andere Gewebe auch unterschiedliche Stammzellen. Haarfollikelstammzellen sind in den äußeren Schichten der Haarbälge lokalisiert und können nach Transplantation differenzierte Haarfollikelabkömmlinge etablieren. Epidermale Stammzellen sitzen in der Basalschicht und differenziertere Zellen wandern in höhere Hautschichten. Melanozytenstammzellen stammen vom Neuralrohr ab und finden sich zusammen mit Haarfollikelstammzellen in den Haarbälgern. Die Stammzellen der Talg- und Schweißdrüsen sind in der myoepithelialen und luminalen Schicht der Schweißdrüsen lokalisiert und proliferieren nur sehr selten.
Unmittelbar nach einer Hautschädigung bildet sich vor Ort ein Fibringerinnsel, das einen weiteren Blutverlust verhindert und auch ein Gerüst für die migrierenden Immunzellen, dermalen und epidermalen Zellen darstellt. Stammzellen aus unterschiedlichen Hautregionen werden umgehend aktiviert, proliferieren und migrieren zur Wunde und bauen die extrazelluläre Matrix um. Fibroblasten sezernieren Kollagen, das die Narbenbildung hervorruft. Bei großen Wunden wird das Kollagen in der Folge umgebaut, Zellen werden abgebaut, und letztlich kompensiert das dermale Narbengewebe den Hautverlust.
Das Immun-Mikroenvironment des Narbengewebes enthält verschiedenste Zellen wie Keratinozyten, die T-Lymphozyten aktivieren und Zytokine sezernieren, die die Narbenbildung fördern. Von Fibroblasten sezernierte Zytokine führen zu kontinuierlichem Wachstum des Narbengewebes, während Zytokine von Makrophagen zusätzliche Immunzellen rekrutieren und die Kollagensynthese stimulieren. Stammzellen hingegen sezernieren antifibrotische Substanzen, die exzessives Kollagen abbauen und die weitere Narbenbildung inhibieren. Wichtige Signalwege, die TGF-β, PI3K/Akt/mTOR, Notch und Wnt umfassen, sind für die Narbenbildung von entscheidender Bedeutung.
Mesenchymale Stromazellen
In der regenerativen Medizin werden mesenchymale Stromazellen (MSZ), die definierte Oberflächenmerkmale haben, in vitro in Osteoblasten, Adipozyten und Chondrozyten differenzieren können und aus unterschiedlichen Geweben wie Knochenmark, Nabelschnurblut, Skelettmuskel, Plazenta oder Fettgewebe gewonnen werden, häufig verwendet. Präklinische Studien zeigten, dass MSZ einen hohen Stellenwert bei der Hautregeneration haben könnten, da sie antiinflammatorische und immunmodulierende Wirkung haben, Kollagen und Elastin synthetisieren, die Aktivierung von Metalloproteinasen inhibieren und vor UV-Licht-induzierter Seneszenz schützen. Die Ko-Kultivierung von MSZ aus Nabelschnurblut mit Fibroblasten aus hypertrophen Narben zeigte eine Suppression der proliferativen und migratorischen Fähigkeiten dieser Fibroblasten sowie die Inhibierung des TGF-β1/Smad3-Signalwegs und seines profibrotischen Phänotyps.
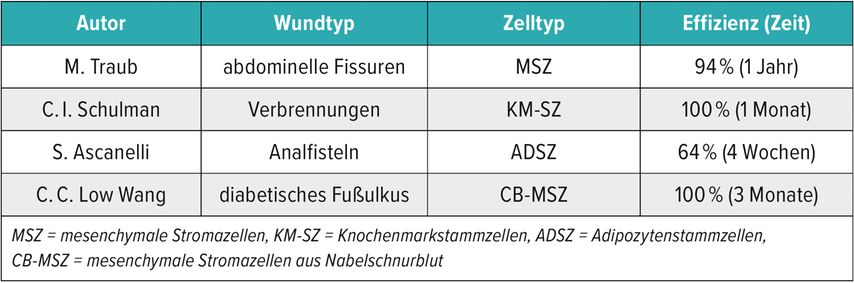
Bisher wurden MSZ zur Verbesserung der Wundheilung klinisch wenig angewandt. Wie aus Tabelle 1 ersichtlich, sind die Indikationen sehr unterschiedlich und die Nachbeobachtungszeiten sehr kurz.
Tab. 1: Klinische Anwendung von mesenchymalen Stromazellen zur Verbesserung der Wundheilung (modifiziert nach Wang D et al.: Stem Cell Res Ther 2025; 16(1): 342)
Neuerdings werden auch Exosomen, die 40–100nm große extrazelluläre Vesikel darstellen und von allen Geweben sezerniert werden können und auch von MSZ und hämatopoetischen Stammzellen stammen können, vermehrt beforscht. Exosomen werden von der endosomalen Membran generiert und enthalten multiple Proteine, Lipide und Nukleinsäuren. Sie regulieren die Proliferation, Differenzierung, Migration, Apoptose und interzelluläre Kommunikation der Zellen. Ihre Sezernierung hängt vom Aktivierungszustand der Zellen ab, sodass ein und dieselbe Zelle unterschiedliche Exosomen bilden kann. Auch für Hautexosomen ist eine Vielzahl an Funktionen aus präklinischen Studien beschrieben, die auch für die Wundheilung und Verhinderung von exzessiver Narbenbildung wichtig sein könnten. So führte die intravenöse Gabe von Exosomen aus Adipozyten-MSZ in einem Mausmodell nach 21 Tagen zu einer Reduktion der Narbengröße und -dicke, Prävention der Differenzierung von Fibroblasten in Myofibroblasten und Inhibierung der Ausbildung von Granulationsgewebe. In einem Kaninchenmodell zu hyperproliferativen Narben wurden nach intravenöser Verabreichung von Exosomen aus Narbengewebezellen nach drei Wochen flachere und weichere Narben mit geringerer Epidermisdicke und niedrigerem Kollagengehalt berichtet.
Die klinische Anwendung von Exosomen ist derzeit noch mit vielen Herausforderungen assoziiert, wie Verbesserung der Isolation von Exosomen, deren Heterogenität, die die Reproduzierbarkeit therapeutischer Effekte in klinischen Studien erschwert, und die Defizite präklinischer Modelle in Hinblick auf humane dermatologische Erkrankungen.
Herausforderungen der Stammzelltherapie in der regenerativen Medizin
Tausende Gruppen weltweit versuchen Produkte aus Stammzellen oder stammzellbasierte Interventionen zu vermarkten, wobei viele fälschlicherweise als stammzellbasiert angepriesen werden, klinisch jedoch noch nicht entsprechend erprobt und geprüft sind und damit neben Kunden-/Patiententäuschung auch Gesundheitsrisiken darstellen könnten. In vielen Ländern und Regionen gibt es auch noch keine gesetzlichen Regulationen, um Kunden zu schützen und eine entsprechende Qualität und Sicherheit der angepriesenen Produkte zu gewährleisten.
Da Stammzellen als „lebende Medikamente“ anzusehen sind, die unterschiedliche Effekte nach In-vivo-Verabreichung bewirken können, sollte unbedingt darauf geachtet werden, dass Labors, die Stammzellen bearbeiten, nach strengen Regeln der Qualitätskontrolle tätig sind, entsprechende Protokolle vorlegen, die eine Reproduzierbarkeit von Ergebnissen ermöglichen und in denen die Substanzen, die in vivo verabreicht werden, auch möglichst gut definiert sind. Dies betrifft alle Arbeitsschritte wie Zellgewinnung und -isolation, Zellkultivierung, Selektionen und andere Manipulationen, die phänotypischen Charakteristika der Zellen, Zellkonzentrationen im finalen Produkt und die Verabreichungsmodi. Auch sind adäquate klinische Studien für jede Form der stammzellbasierten Therapie unbedingt erforderlich, um deren Sicherheit und Wirksamkeit verglichen mit Placebo oder anderen etablierten Therapien zu bestätigen.
Zusammenfassung
Im Bereich der Wundheilung und Narbenbildung hat die präklinische Forschung in den vergangenen Jahren beeindruckende Fortschritte erzielt. So konnte das Immun-Mikroenvironment der Wunden und Narben in Hinblick auf zelluläre Bestandteile und deren Funktionsweise charakterisiert werden und wichtige Signalwege, die bei der Narbenbildung zum Tragen kommen, konnten beschrieben werden. Dies stellt eine wesentliche Voraussetzung für zielgerichtete, individualisierte therapeutische Interventionsmöglichkeiten dar. Die derzeit vorliegenden klinischen Daten rechtfertigen jedoch den routinemäßigen Einsatz von Stammzellen, MSZ oder Exosomen aus unterschiedlichen Zelltypen nicht, zumal neben der fehlenden erwiesenen Wirksamkeit auch nicht die entsprechenden Sicherheitsdaten für eine sichere klinische Anwendung vorliegen. Gerade im Bereich der stammzellbasierten Therapien sollten gute wissenschaftliche klinische Daten vorhanden sein, um die klinische Anwendung bestimmter Produkte evidenzbasiert zu rechtfertigen und den Erwartungshaltungen der Patienten zu entsprechen. Auch muss darauf hingewiesen werden, dass Stammzellen „lebende Medikamente“ darstellen und damit in vivo auch unterschiedliche Wirkungen erzielen könnten. Weiters ist derzeit noch ungeklärt, wie Stammzelltherapeutika verabreicht werden sollen und ob sie im Wundmikroenvironment, bei dem andere Proliferationsbedingungen als in Zellkulturen bestehen, ihre Wirkung entfalten können. All dies sollte in gut definierten klinischen Studien untersucht werden, um bessere Einblicke in die Effizienz stammzellbasierter Therapien zu erhalten.
Literatur:
● Dekoninck S, Blanpain C: Stem cell dynamics, migration and plasticity during wound healing. Nat Cell Biol 2019; 21(1): 18-24 ● Dong X et al.: The regulatory role of immune microenvironment-related cells and pathways in the pathogenesis of keloids. Front Immunol 2025; 16: 1529564 ● Jo H et al.: Application of mesenchymal stem cells in skin regeneration and rejuvenation. Int J Mol Sci 2021; 22(5): 2410 ● Khandpur S et al.: Stem cell therapy in dermatology. Indian J Dermatol Venereol Leprol 2021; 87(6): 753-67 ● Meng X et al.: Umbilical cord-derived mesenchymal stem cells exert anti-fibrotic action on hypertrophic scar-derived fibroblasts in co-culture by inhibiting the activation of the TGFß1/Smad3 pathway. Exp Ther Med 2021; 21(3): 210 ● Wang D et al.: Engineering strategies to enhance the research progress of mesenchymal stem cells in wound healing. Stem Cell Res Ther 2025; 16(1): 342 ● Wang L et al.: Exosomes secreted by human adipose mesenchymal stem cells promote scarless cutaneous repair by regulating extracellular matrix remodelling. Sci Rep 2017; 7(1): 13321 ● Ye H et al.: Personalized human umbilical cord mesenchymal stem-cell derived exosome pre-treatment based on the simulation of scar microenvironment characteristics: a promising approach for early scar treatment. Mol Biol Rep 2025; 52(1): 747
Das könnte Sie auch interessieren:
Unilaterales nävoides Teleangiektasie-Syndrom
Der folgende Fallbericht beleuchtet das seltene unilaterale nävoide Teleangiektasie-Syndrom im Kontext hormoneller Veränderungen während der Schwangerschaft. Anhand einer Patientin ...
S3-Leitlinie „Chronische Wunden“
Chronische Wunden sind ein wachsendes medizinisches und gesundheitsökonomisches Problem. Sie betreffen rund 1–2% der Bevölkerung und sind mit hoher Morbidität, verringerter ...
Excimer-Laser und Lichtbehandlung von Vitiligo und Hypopigmentierungen
Die UV-Phototherapie mit 308nm Excimer-Laser und -Lampen sind in der Behandlung der Psoriasis, aber auch bei Vitiligo und Hypopigmentierungen ein etabliertes Therapieverfahren. Sie ...