Akut symptomatische Anfälle – sind sie alle gleich?
Autoren:
Dr. Matthias Mauritz1
Univ.-Prof. Mag. Dr. Eugen Trinka, FRCP1–3
1 Universitätsklinik für Neurologie, neurologische Intensivmedizin und Neurorehabilitation der PMU
Christian-Doppler-Klinik
Paracelsus Medizinische Universität, Salzburg Mitglied des Europäischen Referenznetzwerkes EpiCARE
2 Department of Public Health
Health Services Research and Health Technology Assessment
UMIT – University for Health Sciences, Medical Informatics and Technology, Hall in Tirol
3 Neuroscience Institut
Christian-Doppler-Klinik
Paracelsus Medizinische Universität, Salzburg
E-Mail: m.mauritz@salk.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Epileptische Anfälle treten bei allen Personen mit Epilepsie auf, aber umgekehrt leidet nicht jede Person, bei der ein epileptischer Anfall auftritt, an Epilepsie. Tatsächlich handelt es sich bei bis zu 40% aller epileptischen Anfälle um akut symptomatische Anfälle (ASA). Eine korrekte Zuordnung von Anfällen als „akut symptomatisch“ ist wichtig, um zugrunde liegende Ursachen rasch zu erkennen und gezielt zu behandeln. Im Hinblick auf Prognose, Therapie mit anfallssuppressiver Medikation (ASM) sowie mögliche zukünftige präventive Therapien ist es aber bedeutsam, ASA differenzierter zu betrachten, da sie sich im Risiko für die nachfolgende Entwicklung von Epilepsie zum Teil beträchtlich unterscheiden.
Die Internationale Liga gegen Epilepsie (ILAE) definiert ASA als „Anfälle, die in einem engen zeitlichen Zusammenhang zu einer akuten Schädigung oder Störung des Gehirns auftreten“.1 Diese Schädigung oder Störung des Gehirns kann „metabolisch, toxisch, strukturell, infektiös oder inflammatorisch“ bedingt sein. Gemeinsam ist den verschiedenen Pathologien, dass sie in einer Hyperexzitabilität des Gehirns resultieren und vorübergehend dessen „Krampfschwelle“ senken. Dies geschieht in Form einer „Dosis-Wirkungs-Beziehung“, d.h., je schwerer die akute Hirnschädigung, desto höher ist im Allgemeinen das Risiko für ASA.
Epidemiologie und Ursachen
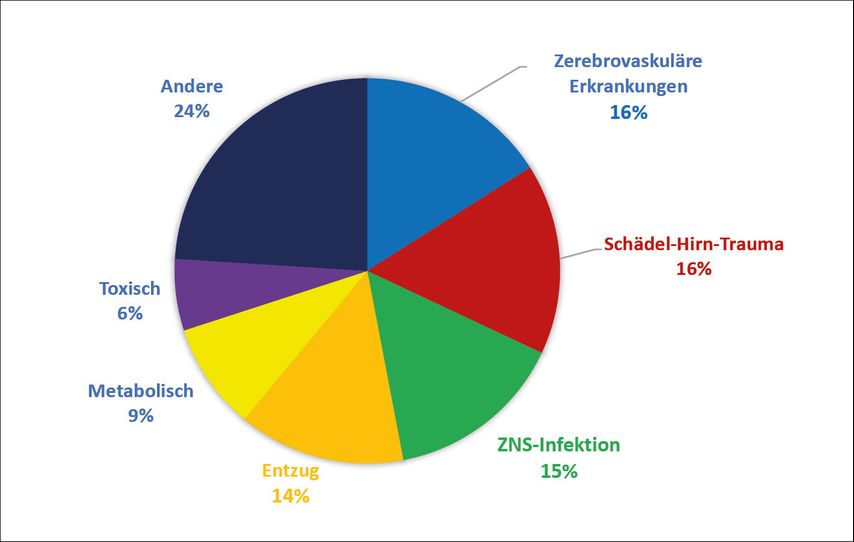
Es handelt sich bei ASA um ein häufiges klinisches Problem: Lässt man Fieberkrämpfe, die prinzipiell die mit Abstand häufigsten ASA, aber eine pädiatrische Entität für sich sind, außer Acht, machen ASA bis zu 40% aller epileptischen Anfälle und 50–70% aller Fälle von Status epilepticus aus.2 ASA betreffen deutlich häufiger Männer als Frauen. Dieser Unterschied wird insbesondere durch ASA in Zusammenhang mit Schädel-Hirn-Trauma und Entzugsanfälle vermittelt. Das Lebenszeitrisiko für einen ASA liegt für eine 80-jährige Person bei 3,6%. Die alterskorrigierte Inzidenz wurde mit 39 pro 100000 Personenjahre berechnet.2 Zerebrovaskuläre Erkrankungen, Schädel-Hirn-Trauma, ZNS-Infektionen und Entzugsanfälle sind zu jeweils ungefähr gleichen Teilen für rund zwei Drittel aller ASA verantwortlich (Abb. 1). Eine Übersicht über die verschiedenen Ätiologien der ASA geben Tabelle 1 und 3. Zudem wird für eine detaillierte Beschreibung der spezifischen Ursachen auf diese frei zugängliche Übersichtsarbeit verwiesen.3
Abgrenzung zu Epilepsie und pathophysiologische Übergänge
Das allgemeine Konzept von ASA sieht vor, dass das Risiko für das Wiederauftreten von Anfällen generell niedrig ist, „sobald sich die zugrunde liegende Ursache bzw. der Auslöser zurückgebildet hat bzw. entfernt wurde und die funktionelle Integrität des Gehirns wiederhergestellt ist“.1 Im Gegensatz dazu steht die Epilepsie, bei der es Voraussetzung ist, dass die Anfälle ohne eine erkennbare akute Ursache, d.h. unprovoziert, auftreten und deren Charakteristikum die Wiederkehr von Anfällen ist.4 Die daraus folgende Annahme, dass es sich bei ASA im Allgemeinen nicht um Epilepsie handelt, ist durch klinische Daten belegt. Eine diesbezüglich grundlegende Arbeit verglich retrospektiv die Häufigkeit des Auftretens von unprovozierten Anfällen zwischen einer Gruppe von 262 Patient:innen mit einem ASA und einer Gruppe von 148 Patient:innen mit einem erstmaligen unprovozierten Anfall.5 In beiden Gruppen lagen dieselben drei Ätiologien (Schlaganfall, Schädel-Hirn-Trauma, ZNS-Infektion) den Anfällen zugrunde, jeweils in einem akut-symptomatischen bzw. in einem entfernt-symptomatischen Zusammenhang. Das Risiko für einen neuerlichen unprovozierten Anfall war in der Gruppe der ASA über einen Zeitraum von 10 Jahren deutlich niedriger (18,7% vs. 64,8%). Die Daten bestätigen die Definition der ASA: ASA stellen im Allgemeinen keine Epilepsie dar, weil sie üblicherweise nicht mit einer anhaltenden Neigung für das Auftreten von Anfällen einhergehen.
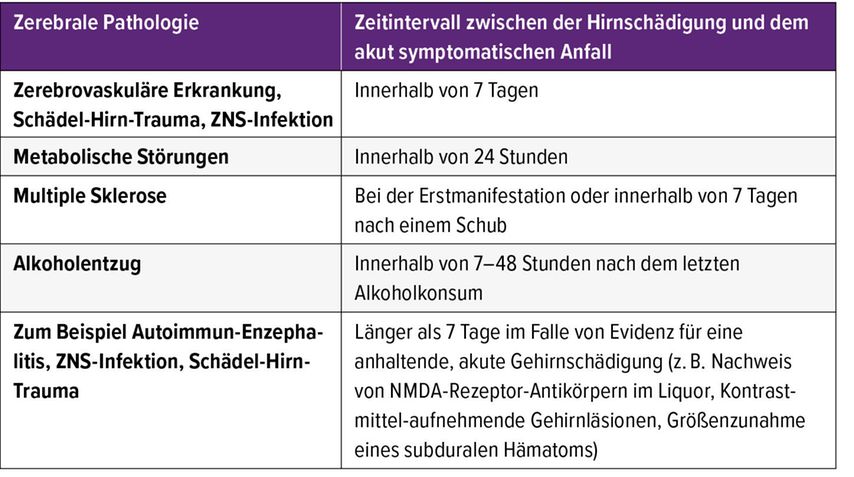
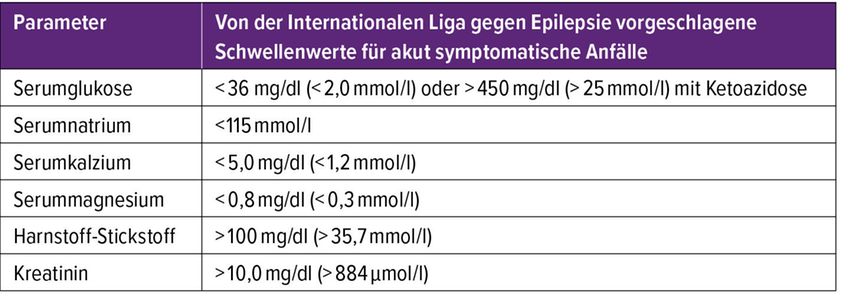
Allerdings gibt es mehrere kritische Punkte in Bezug auf das derzeitige Konzept der ASA.3 Für die Definition eines „engen zeitlichen Zusammenhangs“ zwischen Anfall und akuter Schädigung des Gehirns wurden bestimmte Zeitintervalle von der ILAE festgelegt. Ein Anfall ist demnach als akut symptomatisch zu bewerten, wenn er innerhalb von sieben Tagen nach einem ischämischen oder hämorrhagischen Schlaganfall, einem Schädel-Hirn-Trauma oder einer ZNS-Infektion aufgetreten ist.1 Bei metabolischen Störungen sollte der Anfall innerhalb von 24 Stunden rund um die Diagnose der metabolischen Störung aufgetreten sein (Tab. 1). Zudem wurden zur Definition von ASA im Rahmen von metabolischen Störungen Schwellenwerte festgesetzt, deren Über- oder Unterschreitung einen kausalen Zusammenhang zwischen Anfall und metabolischer Störung wahrscheinlich machen (Tab. 2).
Tab. 2: Von der Internationalen Liga gegen Epilepsie vorgeschlagene Schwellenwerte für akut symptomatische Anfälle
Kritisiert wird, dass die Zeitintervalle und Schwellenwerte teilweise willkürlich gewählt sind.6 Es entsteht dadurch beispielsweise bei Schlaganfall-assoziierten Anfällen eine Dichotomie, die nicht der pathophysiologischen Realität entspricht. So lässt sich beim ischämischen Schlaganfall zwischen der Pathophysiologie von ASA (akute Exzitotoxizität, vermittelt u.a. durch Elektrolytentgleisung, Neurotransmitterfreisetzung, Zusammenbruch der Blut-Hirnschranke etc.) und unprovozierten Anfällen (Epileptogenese, u.a. vermittelt durch Gliose, Angiogenese, chronische Inflammation, Netzwerkveränderungen etc.) keine klare zeitliche Grenze ziehen, sondern es handelt sich hier um einen kontinuierlichen Übergang.7 Dass der Prozess der Epileptogenese nach einem Schlaganfall zudem bereits innerhalb der ersten Tage einsetzt, wird klinisch unter anderem durch ein signifikant höheres Epilepsierisiko für jene ASA, die vier bis sieben Tage nach einem Schlaganfall auftreten, reflektiert.8 Umgekehrt soll ein Anfall bei einem länger akut anhaltenden, aber prinzipiell reversiblen pathophysiologischen Prozess (z.B. NMDA-Rezeptor-Enzephalitis) auch über sieben Tage hinaus als akut symptomatisch betrachtet werden. Letzteres Beispiel ist aber wiederum klar abzugrenzen von Anfällen, die in Zusammenhang mit progressiven Krankheitsprozessen wie Alzheimerdemenz oder Glioblastom auftreten. Diese Anfälle werden als „progressiv symptomatisch“ bezeichnet. Da durch die progressive Pathologie des Gehirns eine anhaltende Neigung zu Anfällen vermittelt wird, muss hier Epilepsie diagnostiziert werden.3Bezüglich der Schwellenwerte für ASA bei metabolischen Störungen ist kritisch anzumerken, dass nicht allein der Absolutwert, z.B. des Serumnatriums, sondern vor allem die Akuität, mit der sich beispielsweise eine Hyponatriämie entwickelt, für das Risiko für ASA entscheidend ist.9
Risiko für Entwicklung einer Epilepsie
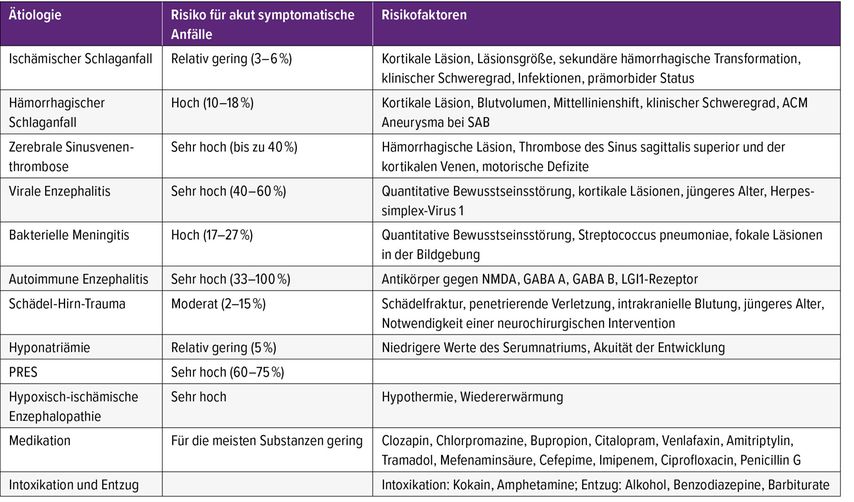
Die wesentliche Problematik der aktuellen Definition von ASA ist jedoch die Tatsache, dass für ASA, die im Zusammenhang mit einer strukturellen Hirnschädigung auftreten, ein zum Teil doch beträchtliches Risiko für die spätere Wiederkehr von unprovozierten Anfällen besteht.3 Beispielsweise kann das Risiko für die Entwicklung von Epilepsie bereits ein Jahr nach einem schweren ischämischen Schlaganfall, in dessen Kontext ein ASA aufgetreten ist, bei über 60% liegen.10 Zudem konnte gezeigt werden, dass ein ASA – vor anderen Risikofaktoren wie klinischem Schweregrad, Größe, Lokalisation oder Ätiologie des Infarktes – der stärkste Prädiktor für die Entwicklung einer Poststroke-Epilepsie ist.11 Tritt der Schlaganfall-assoziierte ASA sogar in Form eines Status epilepticus auf, ist das Risiko am höchsten: Nach zehn Jahren werden über 80% dieser Patient:innen an Epilepsie leiden.12
Demgegenüber stehen ASA, die beispielsweise bei einer Elektrolytentgleisung oder Intoxikation auftreten und für die das Risiko für spätere unprovozierte Anfälle praktisch null ist.13 Wenngleich es wichtig ist, noch einmal zu betonen, dass die Mehrheit aller Patient:innen mit ASA keine Epilepsie entwickelt, besteht in Bezug auf das Epilepsierisiko eine deutliche Heterogenität der ASA. Insbesondere im Hinblick auf die Frage nach einer Therapie mit ASM scheint daher anstelle einer „One size fits all“-Herangehensweise eine differenzierte und individuelle Analyse der ASA wichtig.
Management der ASA
Das Management aller ASA erfordert zunächst immer die rasche Diagnose und Behandlung der zugrunde liegenden Ätiologie (z.B. Thrombektomie beim ischämischen Schlaganfall oder Aciclovir-Gabe bei Herpesenzephalitis).3 Weniger klar ist, ob und wenn ja mit welcher Dauer zudem auch eine Behandlung der ASA mit ASM erfolgen soll. Aktuell herrscht zu dieser Frage ein Mangel an wissenschaftlicher Evidenz, der sich in teilweise unterschiedlichen Therapieempfehlungen bzw. einer Diskrepanz zwischen Guidelines und klinischer Praxis widerspiegelt.13 Beispielsweise empfehlen die aktuellen Richtlinien der Deutschen Gesellschaft für Neurologie (DGN), dass nach einem ersten ASA keine ASM gegeben werden sollten.14 Im Gegensatz dazu zeigen die Erfahrungen aus der klinischen Praxis und wissenschaftliche Daten, dass die meisten Patient:innen mit ASA eine Behandlung mit ASM erhalten. In einer Umfrage bei über 500 Neurolog:innen gaben 95% der Befragten an, ASA in der Regel mit ASM zu behandeln.15 Große Unterschiede zeigen sich für die Dauer der ASM-Therapie: 36% der Befragten verordnen ihren Patient:innen eine Einnahme von ASM für 1–3 Monate, 30% für 3–6 Monate, 13% für 6–12 Monate und 11% der Befragten gaben an, ASM für die Dauer von über einem Jahr zu verordnen. Auch die Analyse von klinischen Daten zeigt, dass die Mehrheit der Fälle von ASA in der Akutphase, aber auch über die Entlassung aus der Klinik hinaus, ASM erhält.16 Prädiktoren für eine ASM-Behandlung sind akute strukturelle Gehirnerkrankungen, eine Behandlung auf der neurologischen Intensivstation und epileptiforme Aktivität im EEG.16 Das Ziel einer Behandlung von ASA mit ASM ist es, weitere ASA zu unterdrücken, um dadurch potenzielle physische, neurologische und metabolische Schäden zu verhindern. Es gibt aus Untersuchungen bei Patient:innen mit Schlaganfall Hinweise, dass ASA unabhängig vom Ausmaß der zugrunde liegenden Ätiologie das Mortalitätsrisiko erhöhen.17,18 Zudem können Anfälle nach einem Schlaganfall zu einer Zunahme der funktionellen Beeinträchtigung führen und den Rehabilitationsprozess negativ beeinflussen.19 Dass ASM prinzipiell wirksam das Risiko für ASA verringern können, wurde in Studien mit Schädel-Hirn-Trauma-Patient:innen gezeigt.20,21 Als Argument gegen eine Behandlung von ASA mit ASM wird angeführt, dass in Untersuchungen zum Schlaganfall nach einem ersten ASA ein relativ geringes Risiko für weitere ASA von 13–22% erhoben wurde.22,23 Das Risiko für wiederholte ASA mag allerdings für andere Pathologien (z.B. Enzephalitis, Sinusvenenthrombose) durchaus höher sein (Tab. 3). Außerdem ist zu berücksichtigen, dass die Häufigkeit von ASA bei ausschließlich klinischer Beobachtung unterschätzt wird: Der zunehmende Einsatz des kontinuierlichen EEG (cEEG) bei kritisch kranken Patient:innen in den vergangenen Jahrzehnten hat gezeigt, dass bis zu 75% der aufgezeichneten elektroenzephalografischen Anfälle keine klinisch beobachtbaren Manifestationen zeigen.24 Ein anderer Einwand gegen die Behandlung von ASA mit ASM in der Akutphase ist die berechtigte Sorge, dass daraus dann eine – in den meisten Fällen nichtindizierte – Dauerverordnung der ASM folgt, die das Risiko für Nebenwirkungen mit sich bringt. Da die Mehrheit der Patient:innen mit ASA eben keine Epilepsie entwickelt, wird allgemein ein relativ rasches Absetzen einer in der Akutphase begonnenen ASM-Therapie empfohlen. Bedauerlicherweise gibt es derzeit keine Evidenz, die das klinische Handeln hierzu, insbesondere in der Frage nach dem „Wann“, unterstützt. Angesichts der bestehenden Dilemmas zum Management der ASA hat eine rezente Übersichtsarbeit den Vorschlag eingebracht, die ASA nach der Dauer einer bestehenden Hyperexzitabilität des Gehirns zu differenzieren.13 Wie lange eine Hyperexzitabilität des Gehirns besteht, wird anhand der Reversibilität der zugrunde liegenden Pathologie sowie der Lokalisation und Schwere der zerebralen Schädigung eingeschätzt. Es wurde eine Einteilung in drei Gruppen mit jeweils spezifischen Managementempfehlungen vorgeschlagen.13 Als ASA mit akuter Hyperexzitabilität von einigen Stunden bis wenigen Tagen werden jene ASA mit vollständig reversibler Ätiologie wie Elektrolytentgleisungen, Medikation, Intoxikation und Entzug verstanden. Für diese Gruppe wird, abgesehen von der obligatorischen Gabe von Benzodiazepinen bei Alkoholentzugsanfall, keine Behandlung mit ASM in der Akutphase empfohlen. Für die Gruppe von ASA, für die eine subakute Hyperexzitabilität von einigen Tagen bis maximal wenigen Wochen angenommen wird, wie z.B. beim posterioren reversiblen Enzephalopathiesyndrom (PRES) oder Anfällen bei Sepsis, wird eine Behandlung mit ASM ausschließlich in der Akutphase und das Absetzen der ASM spätestens bei Entlassung empfohlen. Das Epilepsierisiko für die ASA in dieser Gruppe ist ebenfalls sehr gering. Eine dritte Gruppe wurde als ASA mit prolongierter Hyperexzitabilität bezeichnet und umfasst in erster Linie die Pathologien, die zu einer strukturellen und zum Teil irreversiblen Hirnschädigung führen (u.a. ischämischer und hämorrhagischer Schlaganfall und Schädel-Hirn-Trauma). Für diese Gruppe wird eine Behandlung mit ASM in der Akutphase und unter Umständen auch länger darüber hinaus empfohlen. Ebenso wird vorschlagen, das Epilepsierisiko für diese ASA auf einer individuellen Basis zu beurteilen und danach eine Entscheidung zum Absetzen der ASM zu treffen.
Ausblick
In der Zukunft wären Kalkulatoren hinsichtlich des Epilepsierisikos für ASA verschiedener Ätiologien wünschenswert.13 Diese sollten neben klinischen Variablen auch Biomarker aus den Bereichen Elektrophysiologie, Labor, Genetik und Bildgebung miteinbeziehen. Zur Bestimmung des Epilepsierisikos nach einem ischämischen Schlaganfall existiert beispielsweise bereits seit Längerem der SeLECT-Score, der nun in einem rezenten Update neben klinischen auch EEG-Parameter berücksichtigt.25 Zudem sind randomisierte, kontrollierte Studien zur ASM-Therapie bei ASA notwendig, um unter anderem evidenzbasierte Therapieempfehlungen bezüglich der Dauer einer solchen Therapie abgeben zu können. Abschließend wären eine Biomarker-basierte Risikostratifizierung der ASA und mehr Daten zur ASM-Therapie von ASA auch wichtige Schritte auf der Suche nach einer erfolgreichen Antiepileptogenese-Therapie.26 Die gegenwärtigen ASM unterdrücken lediglich das Auftreten von Anfällen, aber es gibt aktuell keine Therapie, die nach einer Schädigung des Gehirns die Entstehung von Epilepsie verhindert. Eine der bisher größten randomisierten, doppelblind-kontrollierten Antiepileptogenese-Studien untersuchte die diesbezügliche Wirksamkeit einer 30-tägigen Behandlung mit Eslicarbazepin nach einem ischämischen oder hämorrhagischen Schlaganfall.27 Diese Studie, die unter führender österreichischer Beteiligung durchgeführt wurde, blieb – u.a. aufgrund von Rekrutierungsschwierigkeiten während der Covid-19-Pandemie – „underpowered“ und konnte letztlich keine signifikanten Resultate nachweisen.
Literatur:
1 Beghi E et al.: Recommendation for a definition of acute symptomatic seizure. Epilepsia 2010; 51(4): 671-5 2 Annegers JF et al.: Incidence of acute symptomatic seizures in Rochester, Minnesota, 1935-1984. Epilepsia 1995; 36(4): 327-33 3 Mauritz M et al.: Acute symptomatic seizures: an educational, evidence-based review. Epileptic disorders : International Epilepsy Journal with videotape 2022; 24(1): 26-49 4 Fisher RS et al.: ILAE official report: a practical clinical definition of epilepsy. Epilepsia 2014; 55(4): 475-82 5 Hesdorffer DC et al.: Is a first acute symptomatic seizure epilepsy? Mortality and risk for recurrent seizure. Epilepsia 2009; 50(5): 1102-8 6 Shorvon S: The concept of symptomatic epilepsy and the complexities of assigning cause in epilepsy. Epilepsy Behav 2014; 32: 1-8 7 Tanaka T et al.: Pathophysiology, diagnosis, prognosis, and prevention of poststroke epilepsy: clinical and research implications. Neurology 2024; 102(11): e209450 8 Lin R et al.: Risk of post-stroke epilepsy following stroke-associated acute symptomatic seizures. Front Aging Neurosci 2021; 13: 707732 9 Nardone R et al.: Acute symptomatic seizures caused by electrolyte disturbances. J Clin Neurol 2016; 12(1): 21-33 10 Galovic M, Döhler N, Erdélyi-Canavese B, Felbecker A, Siebel P, Conrad J et al.: Prediction of late seizures after ischaemic stroke with a novel prognostic model (the SeLECT score): a multivariable prediction model development and validation study. The Lancet Neurology 2018; 17(2): 143-52 11 Ferreira-Atuesta C et al.: Seizures after ischemic stroke: a matched multicenter study. Ann Neurol 2021; 90(5): 808-20 12 Sinka L et al.: Association of mortality and risk of epilepsy with type of acute symptomatic seizure after ischemic stroke and an updated prognostic model. JAMA Neurol 2023; 80(6): 605-13 13 Yardi R et al.: Antiseizure medication use in acute symptomatic seizures: A narrative review. Epilepsia 2025; 66(4): 955-69 14 Holtkamp M et al.: Erster epileptischer Anfall und Epilepsien im Erwachsenenalter. Clinical Epileptology 2024; 37(2): 118-39 15 Punia V et al.: Immediate and long-term management practices of acute symptomatic seizures and epileptiform abnormalities: A cross-sectional international survey. Epilepsia 2024; 65(4): 909-19 16 Zafar SF et al.: Antiseizure medication use and outcomes after suspected or confirmed acute symptomatic seizures. JAMA Neurol 2024; 81(11): 1159-69 17 Arboix A et al.: Relevance of early seizures for in-hospital mortality in acute cerebrovascular disease. Neurology 1996; 47(6): 1429-35 18 Zöllner JP et al.: National Institutes of Health Stroke Scale (NIHSS) on admission predicts acute symptomatic seizure risk in ischemic stroke: a population-based study involving 135,117 cases. Sci Rep 2020; 10(1): 3779 19Bryndziar T et al.: Seizures following ischemic stroke: Frequency of occurrence and impact on outcome in a long-term population-based study. J Stroke Cerebrovasc Dis 2016; 25(1): 150-6 20 Temkin NR: Antiepileptogenesis and seizure prevention trials with antiepileptic drugs: meta-analysis of controlled trials. Epilepsia 2001; 42(4): 515-24 21 Wilson CD et al.: Early and late posttraumatic epilepsy in the setting of traumatic brain injury: A meta-analysis and review of antiepileptic management. World Neurosurg 2018; 110: e901-e6 22 De Herdt V et al.: Early seizures in intracerebral hemorrhage: incidence, associated factors, and outcome. Neurology 2011; 77(20): 1794-800 23 Leung T et al.: The prognosis of acute symptomatic seizures after ischaemic stroke. J Neurol Neurosurg Psychiatry 2017; 88(1): 86-94 24 Limotai C et al.: How and whom to monitor for seizures in an ICU: A systematic review and meta-analysis. Crit Care Med 2019; 47(4): e366-e73 25 Schubert KM et al.: The Role of electroencephalography in predicting post-stroke seizures and an updated prognostic model (SeLECT-EEG). Ann Neurol 2025, doi: 10.1002/ana.27301 26 Trinka E, Brigo F: Antiepileptogenesis in humans: disappointing clinical evidence and ways to move forward. Curr Opin Neurol 2014; 27(2): 227-35 27Koepp MJ et al.: Antiepileptogenesis after stroke-trials and tribulations: Methodological challenges and recruitment results of a phase II study with eslicarbazepine acetate. Epilepsia Open 2023; 8(3): 1190-201
Das könnte Sie auch interessieren:
Künstliche Intelligenz in der Medizin: Revolution oder Hype?
Die Anwendung künstlicher Intelligenz (KI) in der klinischen Neurologie birgt ein enormes Potenzial, die Diagnose, Behandlung und Versorgung zu revolutionieren. Durch die Analyse großer ...
Susanne Wegener: Reperfusionsversagen betrifft nicht nur Schlaganfall
Prof. Dr. med. Susanne Wegener ist leitende Ärztin an der Klinik für Neurologie des Universitätsspitals Zürich. Neben ihrer klinischen Arbeit ist sie stark in der Forschung tätig. Einer ...
Management von Gliomen 2025
Trotz zahlreicher rezenter Erfolge in der Neurologie und Onkologie hält sich der Fortschritt in der Therapie von Gliomen zurück. Patient:innen mit Gliomen müssen immer noch mit einer ...