Tumorassoziierte Veränderungen im Zellstoffwechsel nutzen – Realität oder Zukunft?
Autor:innen:
Assoz. Prof. Dr. Iris E. Eder-Neuwirt
OA Dr. Michael Ladurner, FEBU
Universitätsklinik für UrologieMedizinische Universität Innsbruck
E-Mail: iris.eder@i-med.ac.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Neben höherem Alter, bestimmer ethnischer Herkunft und positiver Familienanamnese zählen Übergewicht und metabolische Erkrankungen zu den potenziellen Risikofaktoren für Prostatakrebs. Nach dem derzeitigen Wissensstand verändern Tumorzellen ihre Stoffwechselaktivität, um ihren erhöhten Bedarf an Energie und Biomasse abzudecken. Dadurch ergibt sich eine Vielzahl von neuen Möglichkeiten, sowohl für die Diagnostik als auch für die Therapie.
Keypoints
-
Prostatakrebszellen können den Citratzyklus reaktivieren, um für einen optimalen Energiehaushalt zu sorgen.
-
Die PROSPIN-Studie beschäftigt sich mit der Detektion metabolischer Biomarker für die Diagnostik des Prostatakarzinoms.
-
Aktuell konnte sich noch keiner der gefundenen Biomarker in der klinischen Diagnostik durchsetzen.
-
Aufgrund des veränderten Lipid- und Cholesterinstoffwechsels wurde die Wirkweise von Statinen und Metformin bei Prostatakarzinompatienten untersucht.
-
Neu entwickelte Substanzen wie der FASN-Inhibitor TVB-2640 und Telaglenastat in Kombination mit PARP-Inhibitoren werden aktuell untersucht.
-
Ein weiterer Ansatz liegt in der Hemmung des Harnstoffzyklus, der in Prostatatumorzellen zur verstärkten Synthese von Polyaminen genutzt wird.
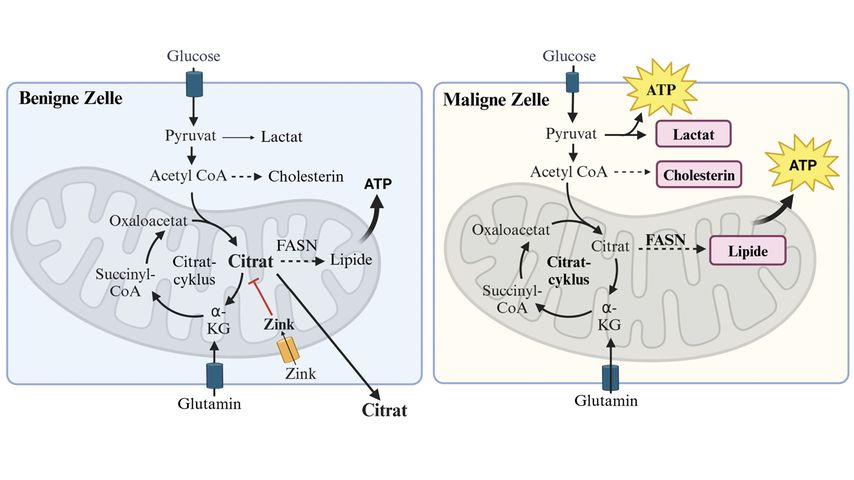
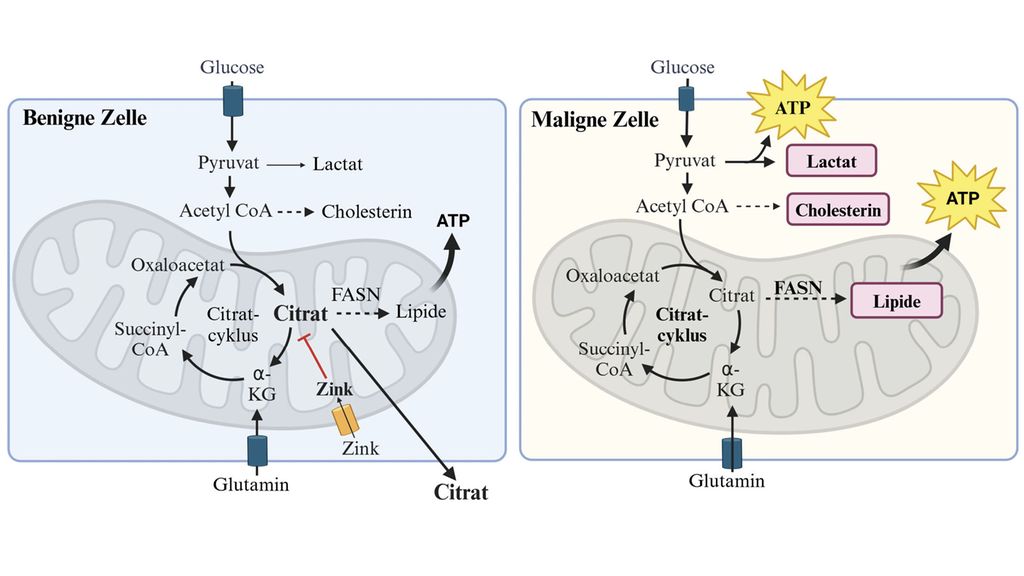
Die normalen Drüsenepithelzellen der Prostata haben einen sehr eigenständigen Metabolismus, da sie typischerweise ungewöhnlich hohe Mengen an Zink aufnehmen, das die Weiterverarbeitung von Citrat im Citratzyklus (auch Krebszyklus genannt) hemmt. Das akkumulierende Citrat wird schließlich aus der Zelle in die Samenflüssigkeit sezerniert (Abb. 1). Prostatakarzinomzellen hingegen reaktivieren den Citratzyklus zur optimalen Energiegewinnung in Form von ATP (Adenosintriphosphat). Gleichzeitig wird in den Tumorzellen die Synthese von Lipiden angekurbelt, die wiederum zur Energiegewinnung, zum Aufbau von Membranstrukturen und zur Aufrechterhaltung von intrazellulären Signalwegen verwendet wird. Tatsächlich wurde in zahlreichen Studien die Fettsäuresynthase (FASN), das Schlüsselenzym der Fettsäuresynthese, in erhöhten Mengen in Prostatakrebszellen nachgewiesen. Es ist außerdem bekannt, dass Prostatatumorzellen eine erhöhte Cholesterin- und Steroidsynthese aufweisen sowie insbesondere in progredienten Stadien vermehrt Laktat produzieren, um zusätzliche Energie in Form von ATP zu gewinnen.
Abb. 1: Energiegewinnung über den Citratzyklus in benignen und malignen Prostataepithelzellen (created with Biorender.com)
Metabolische Veränderungen für Diagnostik und Therapie – was ist in der Pipeline?
Veränderungen im Metabolismus wurden in der Vergangenheit vor allem zur Anwendung in der Krebsdiagnostik untersucht. Die Magnetresonanzspektroskopie (NMR) oder die Massenspektrometrie (MS) sind geeignete Methoden zur Identifizierung von Metaboliten in Körperflüssigkeiten wie Blut und Harn, mit deren Hilfe bereits zahlreiche potenzielle Marker zur Erkennung von Prostatakrebs identifiziert wurden, u.a. Citrat, Succinat, Triglyzeride, Cholesterin, diverse Aminosäuren wie Sarcosin sowie Metaboliten des Harnstoffzyklus wie Harnstoff, Ornithin und Glutamin.1
In einer von unserer Arbeitsgruppe rezent publizierten Arbeit haben wir über 1000 archivierte Serumproben von Männern mit erhöhtem PSA vor Biopsie analysiert und dabei ein typisches Muster bestehend aus 22 Metaboliten identifiziert, das sich bei Prostatakrebspatienten signifikant von dem von Patienten unterscheidet, die in der Histologie nachweislich kein Prostatakarzinom aufweisen. In Kombination mit dem PSA, dem Quotienten für freies PSA (%fPSA) und dem Alter konnten wir mit hoher Effizienz („area under the curve“, AUC: 0,8) bei Männern mit erhöhtem PSA das Vorliegen eines Prostatakarzinoms vorhersagen. Der ableitbare klinische Nutzen war, mit diesem Metabolitenprofil die Zahl der negativen Prostatabiopsien zukünftig reduzieren zu können.2
Der Vorteil der NMR als Analysemethode ist, dass alle Metaboliten innerhalb weniger Minuten und ohne aufwendige Probenvorbereitung in Blut und Harn gemessen werden können. Derzeit wird an der Universitätsklinik für Urologie der Medizinischen Universität Innsbruck die prospektive multizentrische PROSPIN-Studie durchgeführt, um zu untersuchen, ob die Ergebnisse der retrospektiven Analysen reproduziert werden können und die Methode in der Diagnostik Fuß fassen kann. Die Rekrutierung der Patienten läuft noch bis Ende 2025. Es folgen vielversprechende Ergebnisse, die eine potenzielle Verwendung von metabolischen Markern in der Diagnostik unterstützen. Trotzdem hat sich bis dato leider noch keiner dieser Marker für die klinische Anwendung durchgesetzt.
Mögliche Anwendungen in der Prostatakarzinomtherapie?
In den vergangenen Jahren stand hier vor allem die Testung von nebenwirkungsarmen und kostengünstigen Medikamenten, die bereits zur Behandlung beispielsweise von kardiovaskulären Erkrankungen oder Diabetes zugelassen sind, im Vordergrund. Im Hinblick auf die beobachteten Veränderungen im Lipid- und Cholesterinstoffwechsel wurde besonders die Wirkung von Statinen untersucht und tatsächlich ein Zusammenhang zwischen der Einnahme von Statinen und einer Tumorprogression bei Prostatakarzinompatienten beschrieben. Auch Metformin, ein Medikament zur Behandlung von Typ-2-Diabetes, verlängert laut zwei retrospektiven klinischen Studien das Gesamtüberleben von Prostatakarzinompatienten.
Abseits der Untersuchung von sehr verbreiteten Medikamenten gibt es aber auch einige neu entwickelte Substanzen, die in diverse Stoffwechselwege eingreifen und damit die Energiezufuhr der Tumorzellen hemmen sollen. So zum Beispiel der FASN-Inhibitor TVB-2640, der in präklinischen Studien eine tumorinhibierende Wirkung zeigte und als erstes Präparat dieser Wirkstoffgruppe ein akzeptables Sicherheitsprofil aufwies. Auch Telaglenastat, ein Medikament, das die Metabolisierung von Glutamin, einer der am häufigsten vorkommenden und am schnellsten verstoffwechselten Aminosäuren, hemmt, wird derzeit in einer klinischen Phase-II-Studie in Kombination mit PARP-Inhibitoren bei Patienten mit metastasiertem kastrationsresistentem Prostatakarzinom untersucht.3
Interessant erscheint auch der Ansatz einer Hemmung des Harnstoffzyklus, der in Prostatatumorzellen zur verstärkten Synthese von Polyaminen genutzt wird und unter anderem auch in unserer Studie bei Prostatakrebspatienten signifikante Veränderungen aufwies. Der Inhibitor Difluoromethylornithin (DFMO) zeigte in präklinischen Studien vielversprechende Ergebnisse und wird derzeit in einer klinischen Studie an Patienten mit metastasiertem kastrationsresistentem Prostatakrebs, die nach Behandlung mit Abirateron progredient wurden, in Kombination mit Testosteron und Enzalutamid getestet.4
Conclusio
Ob der eine oder andere Ansatz erfolgreich in den klinischen Alltag übergeführt werden kann, wird sich in den kommenden Jahren zeigen. Um die metabolischen Veränderungen der Tumorzellen richtig zu verstehen und für Diagnose und Therapie effizient nutzen zu können, müssen wir uns vor Augen halten, dass der Metabolismus einer jeden Zelle ein äußerst komplexes und hochsensibles Netzwerk aus vielen miteinander verflochtenen Stoffwechselwegen darstellt. Es wird nicht nur durch Interaktion mit der Mikroumgebung des Tumors beeinflusst, sondern reagiert auch hochsensibel auf Veränderungen im Lebensstil, in der Ernährung, dem Hormonhaushalt und der Medikation. Infolgedessen kann sich die Stoffwechselaktivität von Tumorzellen auch im Laufe der Erkrankung und der jeweiligen Therapie verändern. Ein besseres Verständnis der Zusammenhänge von Metabolismus und Tumorbiologie ist hier unumgänglich und wird in Zukunft sicherlich dazu führen, Diagnose und Therapie des Prostatakarzinoms zu verbessern.
Literatur:
1 Markin PA et al.: Plasma metabolomic profile in prostatic intraepithelial neoplasia and prostate cancer and associations with the prostate-specific antigen and the Gleason score. Metabolomics 2020; 16(74): doi: 10.1007/s11306-020-01694-y 3399 2 Ladurner M et al.: An NMR-based metabolic signature to identify clinically significant prostate cancer in patients undergoing biopsy. J Clin Endocrinol Metab 2024; doi: 10.1210/clinem/dgae704 3 Lee RJ et al.: Telaglenastat + Talazoparib in prostate cancer. https://clinicaltrials.gov/study/NCT04824937 ; zuletzt aufgerufen am 21.2.2025 4 Sena LA et al.: Difluoromethylornithine and high dose testosterone with Enzalutamide in metastatic castration-resistant prostate cancer. https://clinicaltrials.gov/study/NCT06059118 ; zuletzt aufgerufen am 28.2.2025
Das könnte Sie auch interessieren:
Korrelation von Stoffwechselmetaboliten mit bildmorphologischen, genetischen und biologischen Markern bei Verdacht auf ein Prostatakarzinom
Das Prostata-spezifische Antigen (PSA), die multiparametrische Magnetresonanztomografie (mpMRT) der Prostata und seltener noch der Prostate-Cancer-Antigen-3-Test (PCA-3) haben sich als ...
Active Surveillance beim Low-Risk-PCa: was uns Studien wirklich lehren
Active Surveillance (AS) bei Prostatakarzinom gewinnt unter den Ärzt:innen zunehmend an Akzeptanz. Patienten wünschen sich vermehrt Informationen dazu, um qualifiziert entscheiden zu ...
Klassifikationssysteme für intraoperative Komplikationen in der Urologie
Intraoperative Komplikationen gehören zum chirurgischen Alltag, deren systematische Erfassung ist jedoch in der Urologie nach wie vor lückenhaft. Vorhandene Klassifikationssysteme werden ...