PSMA-PET: Staging-Diagnostik des Prostatakarzinoms
Autor:
Priv.-Doz. Dr. Jasmin Bektic, FEBU
Urologische Abteilung
Medizinische Universität Innsbruck
E-Mail: jasmin.bektic@tirol-kliniken.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Zur Stadieneinteilung des Prostatakarzinoms (PCa) gehören konventionelle bildgebende Verfahren wie die Computertomografie (CT), die Magnetresonanztomografie (MRT) und die Knochenszintigrafie. In der letzten Dekade hat sich im Vergleich zur herkömmlichen Bildgebung die Prostata-spezifische Membranantigen-Positronenemissionstomografie (PSMA-PET) als signifikant sensitiveres und spezifischeres Verfahren in der Staging-Diagnostik erwiesen. Damit beeinflusst sie signifikant die diagnostischen Arbeitsabläufe und die Planung der Therapie des PCa. Herausforderungen dabei sind ihr richtiger und stadiengerechter Einsatz sowie die Interpretation der Befunde, was einer guten interdisziplinären Zusammenarbeit bedarf.
Keypoints
-
Die PSMA-PET-Diagnostik ist zunehmend als sensitivere und spezifischere Alternative zur herkömmlichen Bildgebung in mehreren Indikationen in Leitlinien integriert.
-
Der Einsatz und die Interpretation der PSMA-PET bedürfen einer guten interdisziplinären Zusammenarbeit.
-
Die PSMA-PET eignet sich nicht als Screeninginstrument für das PCa.
-
Die wichtigsten Indikationen für die PSMA-PET sind das Initialstaging des PCa bei erhöhtem Metastasierungsrisiko und die Tumorlokalisation bei biochemischer Persistenz bzw. bei BCR.
-
Eine negative PSMA-PET soll auf keinen Fall die leitliniengerechte Salvagetherapie verzögern.
-
Beim mCRPC hat die PSMA-PET eine besondere Rolle im Rahmen der Theranostik.
Durch die Verwendung von Radiotracern, die sich spezifisch an PSMA-exprimierende Zellen binden, in Verbindung mit morphologischen Querschnittsbildgebungsverfahren (CT oder MRT) kann eine genauere diagnostische Auswertung erfolgen. Die am häufigsten verwendeten Radiotracer in der PSMA-PET-Bildgebung sind 68Ga-PSMA-11 und 18F-PSMA-1007.
Indikation für die PSMA-PET-basierte Diagnostik
PSMA-PET/CT-basierte Diagnostik hat sich für das primäre Staging von Patienten mit neu diagnostiziertem PCa, für das Staging bei biochemischer Persistenz bzw. bei biochemischen Rezidiven und das Staging von kastrationsresistenten Prostatakarzinomen (CRPC) als signifikant erwiesen. Die PSMA-PET eignet sich nicht als Screeninginstrument für das PCa. Seltene Ausnahmen sind eine inkonklusive Histologie oder negative Biopsie bei hochgradigem Verdacht auf PCa. Die Rolle der PSMA-PET im Rahmen des bereits in konventioneller Bildgebung gesicherten, initial metastasierten PCa ist unklar. Ob die PSMA-PET hier zusätzliche, therapierelevante Informationen liefern kann, wird derzeit in Studien untersucht und bleibt eine Individualentscheidung.
PSMA-PET für das primäre Staging
Die Entscheidung, bei neu diagnostizierten Prostatakarzinompatienten ein bildgebendes Staging durchzuführen, basiert auf einer Risikogruppenklassifizierung. Sie umfasst die Kombination aus PSA-Wert und Gleason-Score in der Biopsie (klassifiziert nach International Society of Urological Pathology grade group system; ISUP) und die klinische Untersuchung der Prostata (digital-rektale Untersuchung, DRU).1 Die Patienten werden in Gruppen mit niedrigem, intermediärem und hohem Risiko für ein biochemisches Rezidiv (BCR) eingeteilt. In der Gruppe mit niedrigem Risiko besteht keine Indikation für das bildgebende Staging und somit auch nicht für die PSMA-PET-Diagnostik. In der Hochrisikogruppe dagegen zeigen Ergebnisse aus prospektiven randomisierten Studien die diagnostische Wertigkeit der PSMA-PET. In den Studien PROSTAGE (konventionelles Staging vs. 18F-PSMA-1007) und proPSMA (konventionelles Staging vs. 68Ga-PSMA-11) ist gezeigt worden, dass das konventionelle Staging mittels CT und Skelettszintigrafie gegenüber der PSMA-PET signifikant unterlegen ist.2,3 In der proPSMA-Studie zeigte die PSMA-PET eine um 27% höhere Genauigkeit bei der Erkennung von Metastasen bei verbesserter Sensitivität (85% vs. 38%) und Spezifität (98% vs. 91%).
Da die PSMA-PET in Kohortenstudien bei Hochrisikopatienten auch eine signifikante Assoziation mit Metastasierungsraten und Mortalität aufweist, sollte ein Staging mit dieser Technik an Bildgebung bei solchen Patienten erfolgen.4 In der Gruppe mit intermediärem Risiko ist die Datenlage noch mangelhaft. Falls die Zusammenschau der vorhandenen Parameter eine Metastasierung wahrscheinlich erscheinen lässt, kann auch hier eine Indikation für die PSMA-PET-Diagnostik gestellt werden. Das gilt im Wesentlichen für die „unfavourable intermediate risk group“, die nach vorliegender Studienlage eher der Hochrisikogruppe zuzuordnen ist. In Abwesenheit von prospektiven, randomisierten Studien, die einen Überlebensvorteil belegen, ist bei therapeutischen Entscheidungen anhand der PSMA-PET Vorsicht geboten.
PSMA-PET nach Behandlung mit kurativer Absicht
Nach radikaler Prostatektomie (RP) kommt es bei 5–20% der Patienten zu einer PSA-Persistenz (PSA≥0,1ng/ml, 4–8 Wochen nach der Operation), was entweder auf verbliebenes oder bereits vorhandenes Tumorgewebe oder verbleibendes gutartiges Prostatagewebe zurückzuführen sein kann. Gerade bei einer PSA-Persistenz nach RP ist ein nicht lokales Rezidiv wahrscheinlich und eine lokale Strahlentherapie eventuell ineffektiv. Die PSMA-PET liefert hier für die weitere Therapieplanung einen wichtigen Zusatznutzen und sollte frühzeitig durchgeführt werden.
Das biochemische Rezidiv ist ein relativ häufiges Problem nach definitiver operativer Therapie oder Strahlentherapie eines PCa (20–50%), wobei die Häufigkeit stark abhängig vom primären Ausgangsstadium ist. Während nach RP ein biochemisches Rezidiv durch einen bestätigten Wiederanstieg des PSA-Werts >0,2ng/ml definiert wird, gilt nach primärer Strahlentherapie nach den RTOG-ASTRO-Phoenix-Kriterien ein PSA-Anstieg von 2ng/ml über dem erzielten Tiefststand als Rezidiv.
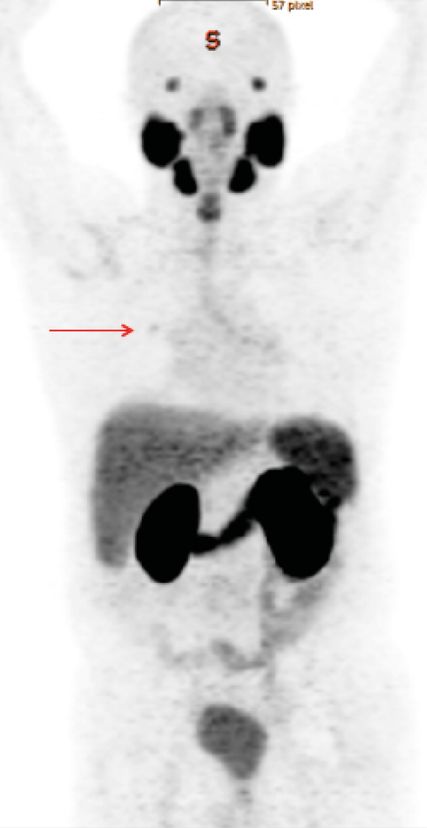
Abb. 1: PSMA-PET-Scan: histologisch bestätigte Lungenmetastase (roter Pfeil) bei Patienten mit einem biochemischen Rezidiv (PSA 0,45ng/ml) nach radikaler Prostatektomie und negativer konventioneller Bildgebung
Konventionelle Bildgebung wie CT/MRT und Knochenszintigrafie haben eine niedrigere Erkennungsrate, wenn der PSA-Wert unter <2ng/ml liegt. Im Gegensatz dazu kann die PSMA-PET/CT die vorhandene Tumoraktivität bereits bei niedrigeren PSA-Werten identifizieren (Abb.1). Ga-PSMA-11-PET kann Tumoren in 33% der Fälle bei PSA-Werten <0,2ng/ml erkennen. In 46% der Fälle werden Tumoren bei PSA-Werten zwischen 0,2 und 0,49ng/ml, in 59% der Fälle bei PSA-Werten zwischen 0,5 und 0,99ng/ml, in 75% der Fälle bei PSA-Werten zwischen 1,0 und 1,99ng/ml und in 97% der Fälle bei einem PSA-Wert >2ng/ml detektiert.5
Gemäß den EAU-Richtlinien sollte eine PSMA-PET/CT durchgeführt werden, wenn der PSA-Wert 0,2ng/ml überschreitet.1 Es ist unbedingt zu beachten, dass eine negative PSMA-PET-Untersuchung auf keinen Fall die leitliniengerechte Salvagetherapie verzögern soll. In Fällen, in denen Metastasen vorhanden sind, kann die PSMA-PET-Diagnostik dabei helfen, eine lokalisierte Salvagetherapie zu steuern, jedoch ist eine Metastasen-gerichtete Therapie (MDT) in Abwesenheit von prospektiven, randomisierten Studien noch als experimentell zu betrachten.
PSMA-PET bei CRPC
Das CRPC wird durch biochemische oder radiologische Progression trotz im Kastrationsbereich gelegener Testosteronserumspiegel definiert (<50ng/dl). Die Unterscheidung zwischen dem metastasierten (mCRPC) und nicht metastasierten (nmCRPC) kastrationsresistenten PCa basiert auf konventioneller Bildgebung mittels CT/MRT und Skelettszintigrafie. Mehr als 50% der in der herkömmlichen Bildgebung mit Status M0 klassifizierten CRPC-Patienten werden nach der PSMA-PET-Untersuchung als M1-CRPC reklassifiziert.6 Trotz vielversprechender Ansätze durch die verbesserte Bildgebung bleibt der tatsächliche Nutzen der PSMA-PET-Bildgebungstechnik für die Patientenprognose bei CRPC noch unklar.
Beim mCRPC hat die PSMA-PET eine besondere Rolle im Rahmen der Theranostik. Das Theranostikprinzip „we treat what we see“ ermöglicht bei der Radioligandentherapie (RLT) mittels Lutetium-177(Lu-177)-markierter PSMA-Antagonisten eine individuelle Indikationsstellung sowie die Evaluation des Therapieerfolges. In aktuellen Studien zeigt sich die PSMA-RLT als vielversprechende Therapieoption für Patienten mit metastasiertem Prostatakarzinom.
Literatur:
1 Cornford P et al.: EAU guidelines (2021) on Prostate Cancer. https://uroweb.org/guideline/prostate-cancer ; zuletzt aufgerufen am 23.1.2024 2 Anttinen M et al.: A prospective comparison of 18F-prostate-specific membrane antigen-1007 positron emission tomography computed tomography, whole-body 1,5T magnetic resonance imaging with diffusion-weighted imaging, and single-photon emission computed tomography/computed tomography with traditional imaging in primary distant metastasis staging of prostate cancer (PROSTAGE). Eur Urol Oncol 2021; 4(4): 635-44 3 Hofman MS et al.: Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study. Lancet 2020; 395(10231): 1208-16 4 Xiang M et al.: Performance of a prostate-specific membrane antigen positron emission tomography/computed tomography-derived risk-stratification tool for high-risk and very high-risk prostate cancer. JAMA Netw Open 2021; 4(12): e2138550 5 Perera M et al.: Gallium-68 prostate-specific membrane antigen positron emission tomography in advanced prostate cancer-updated diagnostic utility, sensitivity, specificity, and distribution of prostate-specific membrane antigen-avid lesions: a systematic review and meta-analysis. Eur Urol 2020; 77(4): 403-17 6 Fendler WP et al.: Prostate-specific membrane antigen ligand positron emission tomography in men with nonmetastatic castration-resistant prostate cancer. Clin Cancer Res 2019; 25(24): 7448-54X