Nierenkrebs – gegenwärtige Strategien und zukünftige Trends in der Therapie
Bericht:
Mag. Dr. Anita Schreiberhuber
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Nichtklarzellige Nierenzellkarzinome (non-ccRCC) sollen zwar nach den gleichen Standards wie ccRCC behandelt werden, die Outcomes sind jedoch schlechter. Bei ccRCC hat sich die adjuvante Therapie als SOC (Standard of Care) etabliert. Im Falle einer Progredienz unter der Erstlinie (1L) soll an die Möglichkeit eines TBP („treatment beyond progression“) gedacht werden, da bei einem gewissen Prozentsatz anPatient:innen noch eine Response erzielt werden kann.
Keypoints
-
Non-ccRCC werden meist mit IO- oder TKI-IO-Kombinationen behandelt, wobei die Ergebnisse schlechter als bei ccRCC ausfallen.
-
In der PAPMET-Studie übertraf Cabozantinib Sunitinib im PFS bei Patienten mit papillärem Karzinom.
-
Die adjuvante Therapie verlängert OS und krankheitsfreies Überleben signifikant. Eine verzögerte CN nach IO könnte vorteilhaft sein und IO-Dubletten zeigen gute Langzeitergebnisse beim mRCC.
-
Die Evidenz zur Resistenzbewältigung ist begrenzt. Lenvatinib + Pembro nach IO-Versagen scheinen vielversprechend zu sein und Belzutifan zeigte in LITESPARK-005 signifikante PFS-Vorteile.
-
Mikrobiommanipulation mit CBM-588, ketogene Diät und körperliches Training könnten die Anti-Tumor-Immunität stärken und an Bedeutung gewinnen.
Mit 15–20% stellen das papilläre (pRCC) und mit 5% das chromophobe (chRCC) Nierenzellkarzinom histologisch die häufigsten Non-cc-Tumoren der Niere dar“, berichtete Prof. Dr. Jürgen Gschwend, TUM Universitätsklinikum, Klinikum rechts der Isar, München, dessen Fokus beim Meeting auf dem Management von non-ccRCC lag. Gschwend machte darauf aufmerksam, dass das chRCC insofern eine Challenge darstellen kann, als es in der Bildgebung (CT und MRT) nur sehr schwer vom benignen Onkozytom unterschieden werden kann. Die Mutation-Load – widergespiegelt durch den Tumor-Inflammation-Signature-Score – variiert bei den RCC-Varianten und ist im Gegensatz zum ccRCC beim pCC und chRCC sehr hoch1 – ein Faktum, das auch für die Therapiewahl lenkend sein könnte.
Was sagen die Guidelines?
Gemäß der deutschen S3-Leitlinie unterscheiden sich die diagnostischen und chirurgischen Strategien nicht von jenen beim ccRCC und für Non-ccRCC sind auch keine anderen therapeutischen Standards verfügbar. Non-ccRCC sollten außerhalb von klinischen Studien mit Immuntherapie (IO) oder Kombinationen eines Tyrosinkinase-Inhibitors (TKI) mit einer IO behandelt werden. Beim chRCC werden mTOR-Inhibitoren als alternative Option angeführt.2 In den Guidelines der European Association of Urology (EAU) werden nur schwache Empfehlungen für die Gabe von Cabozantinib (Cabo) basierend auf den Ergebnissen einer randomisierten klinischen Studie und für Pembrolizumab (Pembro) aufgrund von kleinen einarmigen Studien für das pRCC gegeben. Leider gibt es keine Phase-III-Studien für Patient:innen mit non-ccRCC. Die Ergebnisse aus Subgruppenanalysen und Expanded-Access-Programmen lassen jedoch darauf schließen, dass die Outcomes mit zielgerichteter Therapie schlechter sind als bei Patient:innen mit ccRCC.3
Effektivität von IO, TKI, mTOR-I, MET-I bei Non-cc-RCC
Non-ccRCC dürften auch auf IO nicht besonders gut ansprechen: Sowohl aus einer einarmigen Studie zu Pembro als auch einer zu Nivolumab (Nivo) geht hervor, dass die ORR („overall response rate“) bei pRCC und chRCC maximal knapp 29% betrug.4,5 Auch mit einer Kombination aus Nivo und Ipilimumab (IPI) konnte keine Verbesserung erzielt werden.6 Lediglich Tumoren mit sarkomatoiden Anteilen haben mit einer ORR von 42,14 bzw. 35,7%6 besser abgeschnitten.
Die Ergebnisse zu Everolimus (EVE) vs. Sunitinib (SUN) sind ebenfalls nicht ermutigend. So hat sich lediglich ein Trend zu einem längeren progressionsfreien (PFS) und Gesamtüberleben (OS) unter SUN abgezeichnet, aber in nicht einem signifikanten Ausmaß.7 Da das MET-Onkogen einen Schlüsselfaktor beim pRCC darstellt, wurden in der offenen Phase-II-Studie PAPMET der TKI SUN vs. VEGF/MET-I Cabo vs. den noch selektiveren MET-I Crizotinib vs. Savolitinib in diesem Kollektiv untersucht. Die Zuteilung zu Savolitinib und Crizotinib wurde basierend auf einer präspezifizierten Futilitätsanalyse frühzeitig geschlossen. Gegenüber SUN war das PFS, der primäre Endpunkt, unter Cabo mit 9,0 vs. 5,6 Monaten signifikant länger (HR: 0,60; p=0,019). Auch die ORR war mit 23 vs. 4% höher (p=0,010). Hinsichtlich des OS konnten keine signifikanten Unterschiede zwischen den Armen festgestellt werden. PAPMET war die erste randomisierte Studie, in der mit einer zielgerichteten Therapie ein klinisch und statistisch signifikanter Benefit gegenüber einem existierenden SOC (Standard of Care) nachgewiesen werden konnte.8
SOCs im adjuvanten und metastasierten Setting
Univ.-Prof. Dr. Manuela Schmidinger, Medizinische Universität Wien, erklärte zu Beginn ihres Vortrags, dass mit der adjuvanten Therapie das OS und das krankheitsfreie Überleben signifikant verlängert werden konnten. Insbesondere für Pembro liegen robuste Daten vor, wonach das Rezidivrisiko nur bei 1:1000 liegt.9,10 Zu klären ist der Zeitpunkt der zytoreduktiven Nephrektomie (CN), da Daten vorliegen, die auf eine Überlegenheit einer verzögerten CN nach IO hindeuten.11,12
Beim metastasierten RCC (mRCC) dominieren derzeit IO-basierte Therapien die Therapielandschaft. Insbesondere unter IO-Dubletten wurden beeindruckende Langzeitergebnisse zur Dauer der Response (DOR) und zu den CR(komplette Response)-Raten verzeichnet: So wurden unter IPI + Nivo eine mediane DOR von 82,8 Monaten und 8-Jahres-CR-Raten von 84% erzielt.13
Switch oder TBP bei Resistenz in der 1L?
Für die Vorgehensweise bei Auftreten von Resistenzen unter der 1L gibt es nur wenig Evidenz. „Eine Frage ist, ob es der richtige Moment ist, die Therapie zu switchen. Wir haben gelernt, dass es möglich ist, bei Patient:innen, die initial nicht zu respondieren scheinen, dennoch ein Ansprechen zu induzieren“, so Schmidinger. De facto kann bei bis zu 13% der Betroffenen auch zu einem späteren Zeitpunkt noch eine Response erzielt werden.14 Aus diesem Grund ist Schmidinger der Meinung, dass TBP eine Standardstrategie und keine Ausnahme sein sollte.
Im Fall eines Switches stellt sich die Frage, ob IO-basierte Therapien weitergeführt werden sollen. Leider könnten suboptimale Studiendesigns zur Fehleinschätzung dieser Strategie geführt haben: wenn, wie z.B. in der Phase-III-Studie CONTACT-0315 mit Atezolizumab + Cabo, die falsche IO gewählt wurde. Die Ergebnisse zu Lenvatinib + Pembro nach IO-Versagen könnten aber ein anderes Licht auf die Thematik werfen: Hier belief sich die ORR bei IO-vorbehandelten Patient:innen in Woche 24 auf 55,8%.16 Möglicherweise kommt hier ein „Carry-over-Effekt“ der vorangegangenen Anti-PD-L1-IO zum Tragen: In einer Untersuchung zur Dauer der Rezeptorblockade unter Anti-PD-L1-Therapie konnte gezeigt werden, dass die durchschnittliche Belegung von >70% der PD-1-Moleküle der zirkulierenden T-Zellen noch >2 Monate nach der ersten Infusion nachweisbar war.17
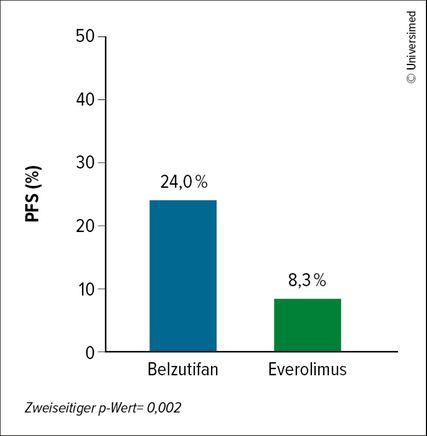
Um die Situation zu verbessern, sollten Substanzen mit einem neuen Wirkmechanismus untersucht werden. Eine vielversprechende Substanz ist der oral verfügbare HIF-2α-I Belzutifan, der zudem auch ein gutes Sicherheitsprofil aufweist: In der offenen Phase-III-Studie LITESPARK-005 wurde Belzutifan mit EVE an 374 ccRCC-Patient:innen mit vorangegangener IO und antiangiogenetischer Therapie verglichen. Der koprimäre Endpunkt setzte sich aus PFS und OS zusammen. In der ersten Interimsanalyse waren nach 18 Monaten unter Belzutifan vs. EVE 24,0 vs. 8,3% der Patient:innen progressionsfrei und am Leben. Damit war Belzutifan der Vergleichssubstanz signifikant überlegen (p=0,002; Abb. 1). Das OS war in der zweiten Interimsanalyse (medianes Follow-up: 25,7 Monate) mit 21,4 vs. 18,1 Monate in nicht signifikantem Ausmaß unter Belzutifan länger (p=0,2). Die finalen Ergebnisse sind noch ausständig.18
Hot Topics in der Zukunft
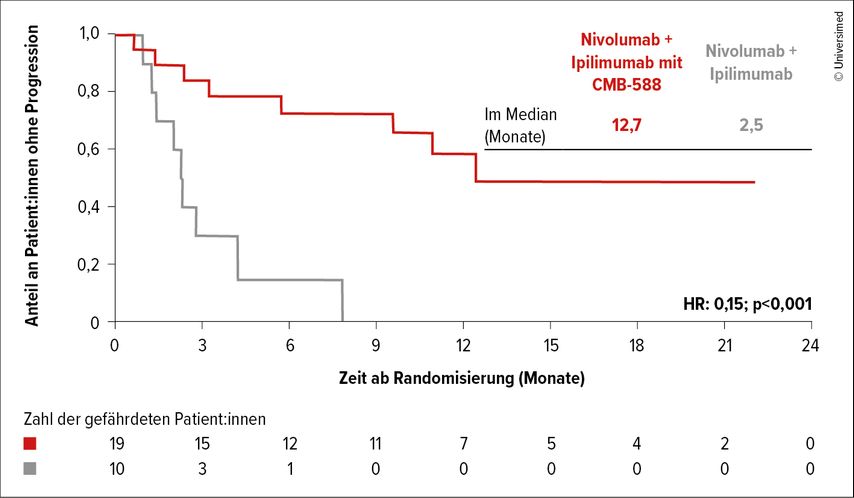
Im dritten Teil ihres Vortrags widmete sich Schmidinger Themen, die vermutlich in den kommenden Jahren noch mehr Aufmerksamkeit gewinnen werden. Eines davon war die bakterielle Manipulation des Mikrobioms: So gibt es bereits Evidenz dafür, dass die Zugabe des bakteriellen Produkts CBM-588 zur IO19 bzw. zu IO + TKI20 auf signifikante Weise das PFS und die Responseraten beeinflusst: Bei der Gabe von Nivo + IPI + CBM-588 war das mediane PFS mit 12,7 Monaten vs. 2,5 Monate signifikant länger (HR: 0,15; p=0,001) als ohne CBM-588 (Abb. 2). Die ORR war, wenn auch nicht statistisch signifikant, mehr als doppelt so hoch (5% vs. 20%; p=0,06).19
Auch mittels ketogener Diät kann die Tumorresponse bei IO im Sinne eines Boosts der Immunsuppression effektiv beeinflusst werden: Die antineoplastischen Effekte führen zu einer Erhöhung der Anti-Tumor-Immunität bei gleichzeitiger Reduktion der Immunsuppression.21
Schließlich gewinnt auch das Thema körperliches Training und Effekte auf die Anti-Krebs-Immunität zunehmend an Bedeutung. Dazu muss angemerkt werden, dass gegenwärtig noch eine große Diskrepanz zwischen der vorliegenden Evidenz für die Effekte von körperlichem Training und dem durchschnittlichen Fitnesslevel einer „gesunden“ Person herrscht.
Quelle:
10th Michael J. Marberger Annual Meeting, 13. Dezember 2024, Wien
Literatur:
1 Danaher P et al.: Pan-cancer adaptive immune resistance as defined by the Tumor Inflammation Signature (TIS): results from The Cancer Genome Atlas (TCGA). J Immunother Cancer 2018; 6(1): 63 2 S3-Leitlinie Nierenzellkarzinom, Version 3.0, November 2021; www.leitlinienprogramm-onkologie.de 3 Ljungberg B et al.: EAU-Guidelines RCC, Update 2024; https://uroweb.org/guidelines/renal-cell-carcinoma 4 McDermott DF et al.: ASCO GU 2019; Abstract #546 5 Vogelzang NJ et al.: Safety and efficacy of nivolumab in patients with advanced non-clear cell renal cell carcinoma: results from the phase IIIb/IV CheckMate 374 study. Clinical GU Cancer 2020; 18(6): 461-8 6 George DJ et al.: Safety and efficacy of first-line nivolumab plus ipilimumab alternating with nivolumab monotherapy in patients with advanced renal cell carcinoma: the non-randomised, open-label, phase IIIb/IV CheckMate 920 trial. BMJ Open 2022; 12(9): e058396 7 Tannir NM et al.: Everolimus Versus sunitinib prospective evaluation in metastatic non-clear cell renal cell carcinoma (ESPN): A randomized multicenter phase 2 trial. Eur Urol 2016; 69(5): 866-74 8 Pal SK et al.: A comparison of sunitinib with cabozantinib, crizotinib, and savolitinib for treatment of advanced papillary renal cell carcinoma: a randomised, open-label, phase 2 trial. Lancet 2021; 379(10275): 695-703 9 Choueiri T et al.: Adjuvant pembrolizumab after nephrectomy in renal-cell carcinoma. NEngl J Med 2021; 385(8): 683-94 10 Choueiri T et al.: ASCO GU 2024; Abstract #LBA359 11 Zerdan B et al.:¸ASCO 2023; Abstract #4552 12 Esagian S et al.: SCO GU 2024; Abstract #440 13 Rini B et al.: Long-term outcomes with nivolumab plus ipilimumab versus sunitinib in first-line treatment of patients with advanced sarcomatoid renal cell carcinoma. J Immunother Cancer 2022; 10(12): e005445 14 Escudier B et al.: Treatment beyond progression in patients with advanced renal cell carcinoma treated with nivolumab in CheckMate 025. Eur Urol 2017; 72(3): 368-76 15 Pal SK et al.: Atezolizumab plus cabozantinib versus cabozantinib monotherapy for patients with renal cell carcinoma after progression with previous immune checkpoint inhibitor treatment (CONTACT-03): amulticentre, randomised, open-label, phase 3 trial. Lancet 2023; 402(10397): 185-95 16 Lee C-H et al.: Lenvatinib plus pembrolizumab in patients with either treatment-naive or previously treated metastatic renal cell carcinoma (Study 111/KEYNOTE-146): a phase 1b/2 study. Lancet Oncol 2021; 22(7): 946-58 17 Brahmer JR et al.: Phase I study of single-agent anti-programmed death-1 (MDX-1106) in refractory solid tumors: safety, clinical activity, pharmacodynamics, and immunologic correlates. J Clin Oncol 2010; 28(19): 3167-75 18 Choueiri T et al.: Belzutifan versus everolimus for advanced renal-cell carcinoma. N Engl J Med 2024; 391(8): 710-21 19 Dizman N et al.: Nivolumab plus ipilimumab with or without live bacterial supplementation in metastatic renal cell carcinoma: a randomized phase 1 trial. Nat Med 2022; 28(4): 704-12 20 Ebrahimi E et al.: ASCO 2023; Abstract #LBA104 21 Stefan VE et al.: Overcoming immunosuppression in cancer: how ketogenic diets boost immune checkpoint blockade. Cancer Immunol Immunother 2025; https://doi.org/10.1007/s00262-024-03867-3