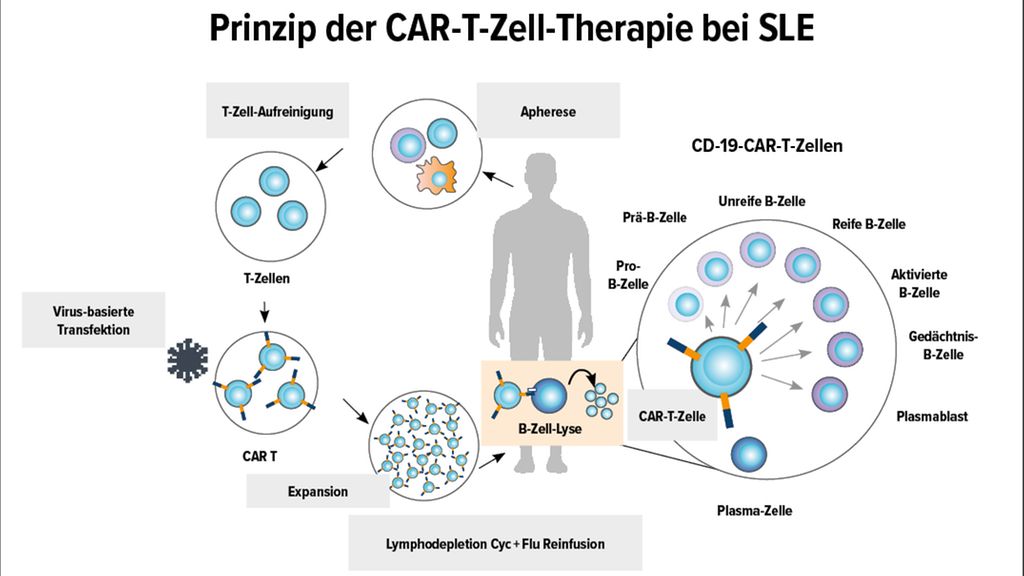
Seit dem Jahr 2021 wird die CAR-T-Zell-Therapie auch in der Behandlung von Autoimmunerkrankungen eingesetzt – dies stellt ein relativ neues Anwendungsfeld dieser Methode außerhalb der Onkologie dar. Prof. Dr. Georg Schett vom Deutschen Zentrum Immuntherapie des Universitätsklinikums Erlangen-Nürnberg fasste die bis dato beachtlichen therapeutischen Erfolge auf dem European Congress of Rheumatology (EULAR) zusammen.
Erstes Einsatzgebiet der CAR-T-Zell-Therapie war die Onkologie: Bereits 2010 wurde sie in den USA erfolgreich bei Leukämien eingesetzt. „Ein CAR ist ein künstlicher Rezeptor, der in die Membran einer lebenden T-Zelle eingebracht wird und mit seiner extrazellulären Domäne – vergleichbar mit einem Immunglobulin – ein spezifisches Antigen auf der Zielzelle erkennt“, erläuterte Schett das Prinzip. Durch die Antigen-Bindung werden die beiden intrazellulären Anteile stimuliert, wodurch die T-Zelle aktiv wird und die Zielzelle abtöten kann. „Was diese Therapieform so besonders macht, ist die Tatsache, dass CAR-T-Zellen ein lebendes Medikament sind und die Zielzellen sowohl erkennen als auch abtöten, also zwei Funktionen in einem haben“, erklärte Schett. „Sie sind extrem effektiv, da sie nach dem Abtöten einer Zielzelle direkt an der nächsten Zelle einsetzbar sind. Und das überall im Körper, sogar im zentralen Nervensystem.“1
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Login
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Registrieren
Erstes Einsatzgebiet der CAR-T-Zell-Therapie war die Onkologie: Bereits 2010 wurde sie in den USA erfolgreich bei Leukämien eingesetzt. „Ein CAR ist ein künstlicher Rezeptor, der in die Membran einer lebenden T-Zelle eingebracht wird und mit seiner extrazellulären Domäne – vergleichbar mit einem Immunglobulin – ein spezifisches Antigen auf der Zielzelle erkennt“, erläuterte Schett das Prinzip. Durch die Antigen-Bindung werden die beiden intrazellulären Anteile stimuliert, wodurch die T-Zelle aktiv wird und die Zielzelle abtöten kann. „Was diese Therapieform so besonders macht, ist die Tatsache, dass CAR-T-Zellen ein lebendes Medikament sind und die Zielzellen sowohl erkennen als auch abtöten, also zwei Funktionen in einem haben“, erklärte Schett. „Sie sind extrem effektiv, da sie nach dem Abtöten einer Zielzelle direkt an der nächsten Zelle einsetzbar sind. Und das überall im Körper, sogar im zentralen Nervensystem.“1