ILD und ILA: von der Früherkennung zur personalisierten Nachsorge
Autor:
OA Clin. Ass. Prof. DDr. Klaus Hackner, MSc.
Klinische Abteilung für Pneumologie
Karl Landsteiner Privatuniversität für Gesundheitswissenschaften
Universitätsklinikum Krems
E-Mail: klaus.hackner@krems.lknoe.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Erkennen interstitieller Lungenanomalien (ILA) als potenzielle Frühstadien interstitieller Lungenerkrankungen (ILD) und die gezielte Identifikation von Hochrisikopatient:innen ermöglichen ein personalisiertes Monitoring.
Keypoints
-
Die frühzeitige Identifizierung von ILD-Hochrisikopatien-t:innen ermöglicht eine personalisierte Überwachung und möglichst zeitnahe Therapieeinleitung.
-
Interstitielle Lungenanomalien sind potenzielle Frühmanifestationen einer ILD und von prognostischer Bedeutung.
-
Ein strukturiertes Vorgehen bildet die Grundlage für eine moderne, interdisziplinäre ILD-Versorgung.
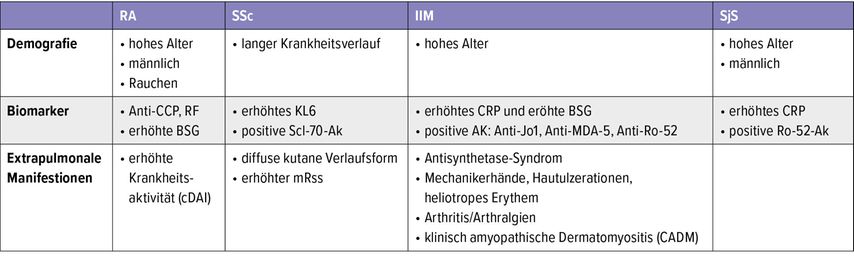
Interstitielle Lungenerkrankungen (ILD) stellen eine heterogene Gruppe von Erkrankungen dar, die durch Schädigung des Lungeninterstitiums und/oder der Alveolen sowie der kleinen Atemwege unterschiedlicher Ätiologie charakterisiert sind. Die rechtzeitige Identifikation von Frühformen ist entscheidend, da eine begleitende ILD den Verlauf vieler Grunderkrankungen signifikant verschlechtert.1–4 Besonders bei Autoimmunerkrankungen wie systemischer Sklerose (SSc), Mischkollagenosen (MCTD), idiopathischen inflammatorischen Myopathien (IIM) und rheumatoider Arthritis (RA) ist die pulmonale Beteiligung ein prognostisch relevanter Faktor (Tab.1).5–7 Mit der zunehmenden Nutzung von hochauflösender Computertomografie (HR-CT) und der Standardisierung von Screening-Empfehlungen rücken nun auch sogenannte interstitielle Lungenanomalien (ILA) als mögliche Frühstadien von ILD in den Fokus der klinischen Forschung.8,9
Tab. 1: Risikofaktoren für die Entwicklung einer ILD bei Kollagenosen und rheumatischen Erkrankungen
Screening-Kriterien und rationale Grundlagen
Die Weltgesundheitsorganisation (WHO) definiert fünf Kriterien, die ein Krankheitsbild erfüllen sollte, um als sinnvoll für ein Screening zu gelten: hohe Prävalenz, identifizierbare Risikogruppen, Verfügbarkeit spezifischer Therapieoptionen, Evidenz für Therapieeffekte und klare Indikationsgrenzen.10Für ILD sind diese Voraussetzungen in einigen Ätiologien weitgehend gegeben.
Zu den Hochrisikopopulationen zählen Patient:innen mit systemischen Autoimmunerkrankungen oder familiärer pulmonaler Fibrose sowie Personen nach onkologischen Therapien (Strahlentherapie, Immun- oder Chemotherapie).11 Auch Nikotinexposition und inhalative Noxen gelten als Risikofaktoren für die Entwicklung und Progression von ILD.12
Studien zeigen, dass das Vorhandensein einer ILD die Überlebensrate bei rheumatologischen Grunderkrankungen und Kollagenosen deutlich reduziert.3,6,13 Auf Basis der Empfehlungen der rezent publizierten ERS/EULAR-Leitlinie für Screening, Diagnose und Therapie von CTD-ILD wird Patient:innen mit SSc und MCTD daher ein routinemäßiges HR-CT-Screening empfohlen, da die ILD-Prävalenz hoch und der Verlauf potenziell schwer ist.14
Für RA und IIM erfolgt die Indikationsstellung risikoadaptiert – insbesondere bei positiver Autoantikörperkonstellation (z.B. Anti-CCP, Rheumafaktor bzw. MDA5, Jo-1) und hoher Krankheitsaktivität.14,16 Für RA sind außerdem noch das männliche Geschlecht, höheres Alter sowie eine Nikotinanamnese Risikofaktoren für die Entwicklung einer ILD. Für IIM sind klinische Erscheinungen wie das Anti-Synthetase-Syndrom, Mechanikerhände, Hautulzerationen, Arthritiden/Arthralgien, ein heliotropes Erythem und die klinisch amyopathische Dermatomyositis Risikofaktoren für die Entwicklung einer ILD. Unklar bleibt allerdings zurzeit noch, wie die Gewichtung der Risikofaktoren erfolgen sollte bzw. wie viele Risikofaktoren tatsächlich für eine Screening-Empfehlung vorliegen sollten.
Bei diesen Patientengruppen kann eine strukturierte Früherkennung nicht nur zur Verbesserung der Prognose, sondern auch zur gezielten Therapieeinleitung beitragen. Dies bedeutet allerdings auch eine relevante Zahl an zusätzlichen HR-CT-Untersuchungen, da ein Thoraxröntgen nicht zum Screening einer ILD ausreicht. Ein epidemiologisches Rechenbeispiel zeigt Folgendes: Hochrechnungen zufolge leben in Österreich etwa 60000 bis 90000 Personen mit RA, von denen rund ein Drittel männlich ist. Etwa 14000 bis 24000 Männer mit RA über 50 Jahre könnten somit einer Gruppe mit erhöhtem ILD-Risiko angehören und würden sich für ein HR-CT-Screening qualifizieren.17
Unter Hinzurechnung der weiteren Risikofaktoren würde sich eine noch viel größere Gruppe für ein ILD-Screening qualifizieren, sowohl bei RA als auch anderen Erkrankungen aus dem rheumatischen Formenkreis. Mit großem Interesse werden die finalen Daten der ANCHOR-RA-Studie im nächsten Jahr erwartet, welche die Rolle der einzelnen Risikofaktoren genau aufschlüsseln sollen und die ILD-Screening-Empfehlungen womöglich noch detaillierter machen. Nicht zuletzt aufgrund der steigenden Zahlen von erforderlichen HR-CT-Untersuchungen wird in den Leitlinien auch die Thoraxsonografie als zusätzliches nichtinvasives Tool zum laufenden Screening bei Risikopatient:innen für eine ILD empfohlen.18
ILA – zwischen Befund und Krankheit
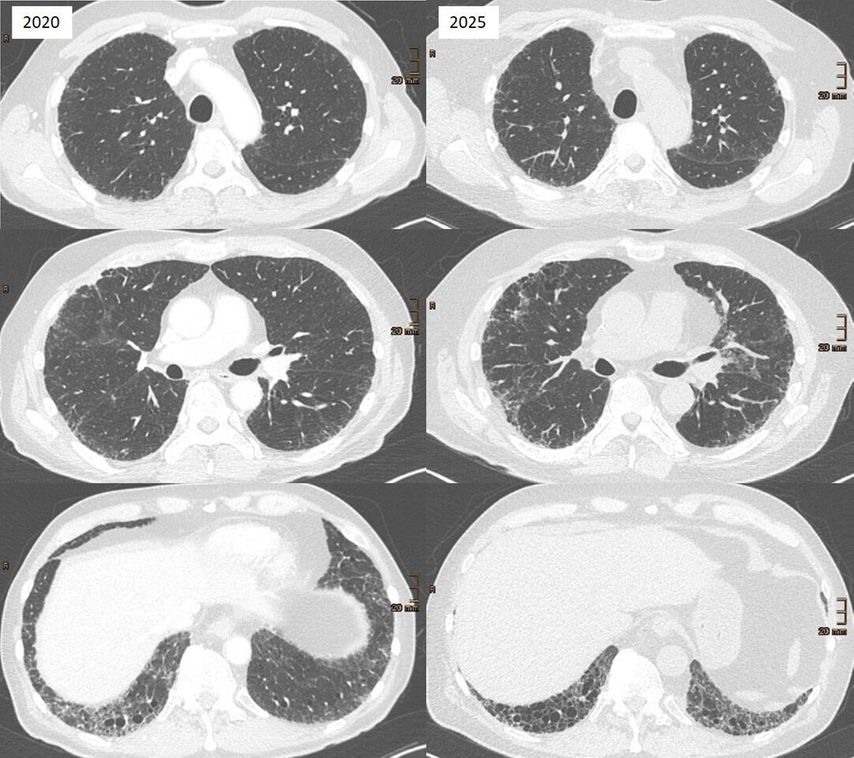
Interstitielle Lungenanomalien sind radiologische Veränderungen, die typischerweise als Zufallsbefund bei CT-Untersuchungen entdeckt werden. Nach der Fleischner-Definition von 2020 handelt es sich um bilaterale, nichtgravitationsabhängige Lungenveränderungen wie Milchglastrübungen, Retikulationen, Traktionsbronchiektasen oder Honeycombing (Honigwabenmuster), die mindestens 5% eines Lungenareals betreffen.19 Die neue Definition der American Thoracic Society (ATS) von 2025 erweitert diese Kriterien, indem sie auch Hochrisikopatient:innen ohne klassischen Zufallsbefund einschließt.2 ILA gelten heute als prämorbides Stadium einer ILD (Abb.1). In einer großen retrospektiven Studie bei 1699 Teilnehmer:innen eines Lungenkrebs-Screenings entwickelten 25% der Personen mit ILA im Verlauf eine manifeste ILD; die mediane Zeit bis zur Diagnose betrug 4,5 Jahre. Zudem war ILA ein unabhängiger Mortalitätsprädiktor.2
Abb. 1: Beispiel eines progredienten Verlaufs von interstitiellerLungenanomalie (ILA) zu interstitieller Lungenerkrankung (ILD)
Die klinischen Risikofaktoren für eine Progression von ILA zu ILD umfassen Nikotinkonsum und inhalative Expositionen, vorausgegangene onkologische Therapien sowie eine abnorme oder grenzwertige Lungenfunktion (z.B. eingeschränkte FVC, DLCO oder TLC). Zu den radiologischen Risikofaktoren zählen ILA subpleuraler oder basaler Dominanz, das Vorliegen von Honeycombing und Traktionsbronchiektasen sowie ein ausgedehnter Befall einzelner Zonen oder ganzer Lungenabschnitte.
Patient:innen mit Symptomen (Dyspnoe, Husten), eingeschränkter Lungenfunktion oder radiologisch progredienten Befunden sollten in einem ILD-Zentrum vorgestellt werden.19 Das Follow-up-Intervall richtet sich nach dem radiologischen Progressionsrisiko und sollte individuell festgelegt werden. Eine Empfehlung durch die Österreichische Gesellschaft für Pneumologie (ÖGP) zum praktischen Umgang mit zufällig entdeckten ILA wird in den nächsten Monaten erwartet.
Familiäre pulmonale Fibrose – genetische Aspekte
Familiäre Formen der pulmonalen Fibrose machen etwa 10–20% der idiopathischenFälle aus.20 Eine genetische Testung ist insbesondere bei ILD-Diagnose bei Verwandten ersten oder zweiten Grades, bei idiopathischer pulmonaler Fibrose (IPF) vor dem 50. Lebensjahr oder bei klinischem Verdacht auf ein Short-Telomere-Syndrom angezeigt.Analysiert werden Telomer- und Surfactant-assoziierte Gene wie TERT, TERC, SFTPA, SFTPB, SFTPC, SFTPD und ABCA3. Auch die Telomerlängenmessung kann zusätzliche diagnostische Hinweise geben. Eindeutige Screening-Empfehlungen und eine Harmonisierung der Testung sind noch ausständig und werden derzeit von der ÖGP im Rahmen eines Projekts der Austrian Respiratory Coalition erarbeitet.
Praktische ILD-Screening-Empfehlungen auf Basis rezenter Publikationen
-
SSc und MCTD: immer HR-CT-Screening bei Diagnosestellung
-
RA und IIM: Screening bei Risikofaktoren (z.B. Autoantikörper, Dyspnoe, pathologische Lungenfunktion) empfohlen
-
ILA: Abklärung auf mögliche ILD bei Symptomatik oder Funktionseinschränkung; bei ILD: Weiterleitung an ein Zentrum
-
ILA-Verlaufskontrolle: abhängig von radiologischen Progressionsfaktoren
-
IPF bei positiver Familienanamnese: genetische Testung bei zwei betroffenen Verwandten oder sehr frühem Krankheitsbeginn möglich
-
Lungenultraschall: kann bei geübten Untersucher:innen als einfaches Screeningtool ergänzend eingesetzt werden.
Schlussfolgerung
Das Screening interstitieller Lungenerkrankungen und das Erkennen interstitieller Lungenanomalien haben sich zu klinisch etablierten Strategien entwickelt. Die frühzeitige Identifikation von Hochrisikopatient:innen ermöglicht eine personalisierte Überwachung und gegebenenfalls eine frühe Therapieeinleitung.
ILA sind dabei nicht mehr als zufällige Befunde zu betrachten, sondern als potenzielle Frühmanifestationen einer ILD mit prognostischer Relevanz. Ein strukturiertes Vorgehen – von der Definition klinischer Risikogruppen über die radiologische Charakterisierung bis zur genetischen Abklärung – bildet die Grundlage für eine moderne, interdisziplinäre ILD-Versorgung.
Literatur:
1 Antoniou K et al.: ERS/EULAR clinical practice guidelines for connective tissue disease-associated interstitial lung disease Developed by the task force for connective tissue disease-associated interstitial lung disease of the European Respiratory Society (ERS) and the European Alliance of Associations for Rheumatology (EULAR) Endorsed by the European Reference Network on rare respiratory diseases (ERN-LUNG). Eur Respir 2025; https://doi.org/10.1183/13993003.02533-2024 2 Podolanczuk AJ et al.: Approach to the evaluation and management of interstitial lung abnormalities: an official American Thoracic Society clinical statement. Am J Respir Crit Care Med 2025; 211(7): 1132-55 3 Ariani A et al.: Overall mortality in combined pulmonary fibrosis and emphysema related to systemic sclerosis. RMD Open 2019; 5(1): e000820 4 Guillén-Del-Castillo A et al.: Impact of interstitial lung disease on the survival of systemic sclerosis with pulmonary arterial hypertension. Sci Rep 2022; 12(1):5289 5 Cottin V, Brown K: Interstitial lung disease associated with systemic sclerosis (SSc-ILD). Respir Res 2019; 20(1): 13 6 Moinzadeh P et al.: Impact of systemic sclerosis-associated interstitial lung disease with and without pulmonary hypertension on survival: a large cohort study of the German Network for Systemic Sclerosis. Chest 2024; 165(1): 132-45 7 Bongartz T et al.: Incidence and mortality of interstitial lung disease in rheumatoid arthritis: a population-based study. Arthritis Rheum 2010; 62(6): 1583-91 8 Hatabu H et al.: Interstitial lung abnormalities detected incidentally on CT: a Position Paper from the Fleischner Society. Lancet Respir Med 2020; 8(7): 726-37 9 Patel SA et al.: Interstitial lung abnormalities in a large clinical lung cancer screening cohort: association with mortality and ILD diagnosis. Respir Res 2023; 24(1): 49 10 WHO: Screening programmes: a short guide. Increase effectiveness, maximize benefits and minimize harm. 2020; www.who.int/europe/publications/i/item/97892890547822 ; zuletzt aufgerufen am 27.10.2025 11 Hyldgaard C et al.: A population-based cohort study of rheumatoid arthritis-associated interstitial lung disease: comorbidity and mortality. Ann Rheum Dis 2017; 76(10): 1700-6 12 Juge PA et al.: Methotrexate and rheumatoid arthritis associated interstitial lung disease. Eur Respir J 2021; 57(2): 2000337 13 Solomon J et al.: Predictors of mortality in rheumatoid arthritis-associated interstitial lung disease. Eur Respir J 2016; 47(2): 588-96 14 Johnson S et al.: 2023 American College of Rheumatology (ACR)/American College of Chest Physicians (CHEST) Guideline for the screening and monitoring of interstitial lung disease in people with systemic autoimmune rheumatic diseases. Arthritis Care Res 2024; 76(8): 1201-13 15 Hackner K et al.: Screening for rheumatoid arthritis-associated interstitial lung disease--a Delphi-based consensus statement. Z Rheumatol 2024; 83(2): 160-8 16 Sparks J et al.: Design of ANCHOR-RA: a multi-national cross-sectional study on screening for interstitial lung disease in patients with rheumatoid arthritis. BMC Rheumatol 2024; 8(1): 19 17 Grohs M et al.: Value of CT and transthoracic lung ultrasound in patients with systemic sclerosis: joint statement of the ÖRG/ÖGP/ÖGR/ÖGUM. Z Rheumatol 2022; 81(7): 610-8 18 Laursen C: European Respiratory Society statement on thoracic ultrasound. Eur Respir J 2021; 57(3): 2001519 19 Hatabu H et al.: Interstitial lung abnormalities detected incidentally on CT: a position paper from the Fleischner Society. Lancet Resp Med 2020; 8(7): 726-37 20 Borie R et al.: European Respiratory Society statement on familial pulmonary fibrosis. Eur Respir J 2023; 61(3): 2201383
Das könnte Sie auch interessieren:
Asthma bronchiale: Herausforderungen bei Kindern und Jugendlichen
Asthma bronchiale ist eine chronische Krankheit, die im Kindesalter andere Herausforderungen mit sich bringt als bei Erwachsenen. Die physikalische Untersuchung sowie die Therapie sind ...