Die Mechanismen von Zellsekretom in Wundheilung und Narbenbildung
Autor:innen:
Dr. Vera Vorstandlechner, PhD1–3
Univ.-Prof. Dr. Hendrik J. Ankersmit1,2
Assoc. Prof. PD Dr. Michael Mildner4
1 Laboratory for Cardiac and Thoracic Diagnosis, Regeneration and Applied Immunology, Abteilung für Thoraxchirurgie, Medizinische Universität Wien
2 Aposcience AG, Wien
3 Abteilung für Plastische und Rekonstruktive Chirurgie, Medizinische Universität Wien
4 Abteilung für Dermatologie und Venerologie, Medizinische Universität Wien
E-Mail: michael.mildner@meduniwien.ac.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Damit die Wundheilung in der menschlichen Haut optimal verlaufen kann, müssen verschiedene molekulare und zelluläre Mechanismen, die ineinandergreifen, reibungslos ablaufen.
Keypoints
-
Das Sekretom von mononukleären Zellen (PBMCsec) kann regenerative Prozesse in verschiedensten Pathologien unterstützen.
-
PBMCsec verbessert die Qualität von Narbengewebe durch mehrere Wirkmechanismen, unter anderem die Unterdrückung der Differenzierung von Myofibroblasten und die übermäßige Ausschüttung extrazellulärer Matrix.
Die regenerative Medizin, die darauf abzielt, die körperliche Integrität wiederherzustellen und Defekte möglichst narbenfrei zu heilen, ist von zentraler Bedeutung für die plastische Chirurgie. Über Jahrtausende hinweg wurden verschiedene Mittel, darunter Kräuter, Chemikalien und tierische Bestandteile, verwendet, um Heilungsprozesse zu unterstützen, ein jugendliches Aussehen wiederherzustellen und Alterungsprozesse umzukehren. Der Gedanke, Zellen für therapeutische Zwecke zu nutzen, hat historische Wurzeln. Bereits im 19. Jahrhundert führte Paul Niehans erste Anwendungen durch, bei denen er xenogene Zellsuspensionen subkutan injizierte, um die Funktion geschädigter Gewebe zu regenerieren. Diese frühen Zelltherapien legten den Grundstein für die spätere Entwicklung der Stammzellforschung zur Geweberegeneration. Besonders in den späten 1990er- und frühen 2000er-Jahren erlangte die Stammzellforschung große Bedeutung, da Stammzellen als vielversprechende Quelle für die Wiederherstellung beschädigter Gewebe angesehen wurden.
In der plastischen Chirurgie wurde der Effekt verschiedener Stammzellentypen, insbesondere mesenchymaler Stammzellen (MSC) aus Fettgewebe, Knochenmark, Haarfollikeln oder Nabelschnur, in zahlreichen Studien untersucht. Die Untersuchungen konzentrierten sich dabei auf die Gewebsregeneration, die Wundheilung und verschiedene andere Pathologien.1 Die Ergebnisse zeigten, dass MSC eine signifikante Wirksamkeit bei der Förderung der Wundheilung, der Hautverjüngung und der Verbesserung von Narben aufweisen. Die anfänglichen Erfolge der Stammzellmedizin in der Gewebsregeneration, die in präklinischen Tierversuchen teils spektakuläre Ergebnisse zeigten, führten in den ersten klinischen Studien am Menschen jedoch zu enttäuschenden Resultaten. Zudem sind die MSC schwer handhabbar, zeitaufwendig und kostspielig in der Herstellung, und ihre Gewinnung erfordert invasive Verfahren sowie eine autologe patientenspezifische Aufbereitung.
In nachfolgenden Untersuchungen wurde die Hypothese aufgestellt, dass nicht die Stammzellen selbst, sondern deren sezernierte Faktoren, das sogenannte Sekretom, den regenerativen Effekt vermitteln könnten. Das Forschungsteam um Ankersmit postulierte in diesem Zusammenhang, dass auch einfacher zugängliche Zellen, wie beispielsweise Leukozyten und insbesondere apoptotische periphere Blutmononuklearzellen (PBMC), diesen Effekt zeigen könnten. Die Gruppe um Ankersmit demonstrierte anschließend, dass die Infusion von apoptotischen PBMC bei Schweinen mit Myokardinfarkt das Myokard vor weiteren Schäden schützen und teilweise regenerieren konnte.2,3 Als hypothetischer Wirkmechanismus wurde vorgeschlagen, dass apoptotische Zellen, insbesondere nach Bestrahlung, protektive Faktoren sezernieren, die den umliegenden Zellen ein „Gefahrensignal“ vermitteln. Dieses Signal kann die umliegenden Zellen dazu veranlassen, sich auf die Gefahr vorzubereiten, was letztlich das Überleben und die verbesserte Regeneration des Gewebes unterstützt.
Das Sekretom von peripheren mononukleären Zellen als Unterstützer der Regeneration
In den Jahren nach den Herzinfarkt-Studien untersuchte das Team um Hendrik Jan Ankersmit die Anwendung von PBMCsec, dem Sekretom bestrahlter peripherer Blutmononuklearzellen (Aposec™), in verschiedenen Modellen zur Gewebsregeneration. PBMCsec zeigte dabei vielversprechende Ergebnisse, indem es die Wundheilung bei Mäusen, die Heilung von Verbrennungswunden bei Schweinen, die Regeneration bei fokaler zerebraler Ischämie, Wirbelsäulenverletzungen bei Ratten und die Durchblutung lokaler Lappenplastiken verbesserte. Mechanistische Studien zu PBMCsec enthüllten dessen antiinflammatorische und antimikrobielle Eigenschaften. PBMCsec wirkt zudem proangiogen, erhöht die Zellmotilität, verhindert die Aktivierung von dendritischen Zellen, Mastzellen und Basophilen, verbessert die endotheliale Barrierefunktion in Blutgefäßen und verhindert die Bildung von Neutrophil Extracellular Traps (NETs), die nach äußeren Noxen zu weiterem Gewebeschaden beitragen können. Das Sekretom enthält zahlreiche Komponenten, darunter Lipide, Proteine (wie Wachstumsfaktoren und Interleukine), extrazelluläre Vesikel und freie DNA. Studien von Wagner et al. und Simader et al. zeigten, dass nur das vollständige Sekretom seine regenerative Wirkung entfaltet, während die einzelnen Bestandteile oder das Sekretom von isolierten Zelltypen (z.B. nur T-Zellen oder nur Monozyten) diese Effekte nicht reproduzieren konnten.1,4,5
Aufbauend auf diesen Arbeiten untersuchten wir, ob PBMCsec die Bildung von Narben verringern und die Qualität bestehender Narben verbessern kann. In der Studie von Hacker et al. zur Heilung von Verbrennungswunden bei Schweinen deuteten erste Ergebnisse auf weicheres und elastischeres Narbengewebe durch die Anwendung von PBMCsec hin.6 Da Narbenbildung und Hautregeneration äußerst komplexe Prozesse sind, an denen nahezu alle Zelltypen der Haut beteiligt sind, setzten wir die Einzelzellsequenzierung (scRNAseq) in verschiedenen Mausmodellen zur Narbenbildung ein. Mit dieser Methode konnten wir pro Probe etwa 10000 Zellen (einschließlich Fibroblasten, Endothelzellen, Monozyten, Perizyten, T-Zellen, Keratinozyten und Melanozyten) sowie 2000 bis 3000 Gene pro Zelle analysieren. Dieser umfassende Ansatz ermöglichte es uns, zentrale Mechanismen zu identifizieren und zu bestätigen, durch die PBMCsec die Narbenqualität verbessert. Im Mausmodell bewirkte PBMCsec erwartungsgemäß eine schnellere Wundheilung. Darüber hinaus zeigte PBMCsec eine wesentlich stärkere Genregulation bei der topischen Anwendung auf frischen Wunden während der Narbenbildung im Vergleich zur subkutanen oder intrakutanen Injektion in bestehende Narben. PBMCsec führte zu einer umfassenderen Herabregulation als Hochregulation der Genexpression in allen untersuchten Zelltypen.7
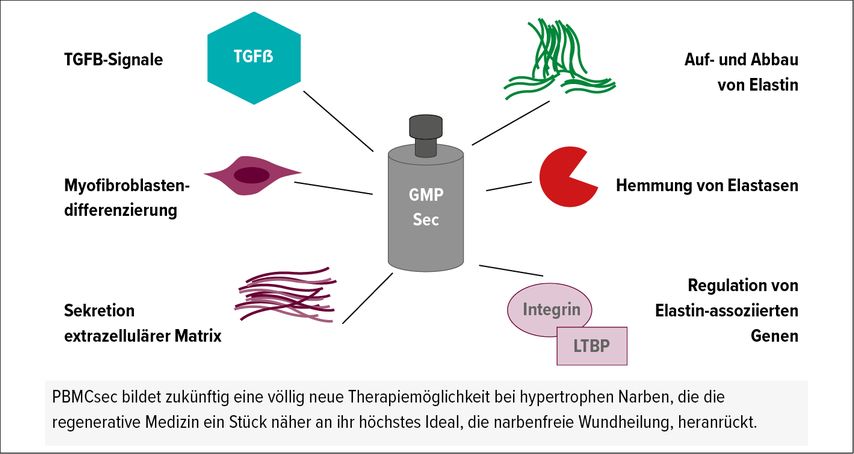
PBMCsec verhinderte in vitro auch die durch Transforming Growth Factor beta (TGF-β) vermittelte Differenzierung von Fibroblasten zu Smooth Muscle Actin (SMA) exprimierenden Myofibroblasten. Diese Myofibroblasten sind durch ihre Kontraktilität und übermäßige Sekretion von Bestandteilen der extrazellulären Matrix, wie Kollagen, Fibrillin und Elastin, maßgeblich an der Bildung hypertropher und kontrakter Narben beteiligt. In vivo zeigte sich dieser Mechanismus bei Mäusen durch eine geringere Präsenz von SMA-positiven Zellen, also weniger Myofibroblasten, in den gereiften Narben. Darüber hinaus reguliert PBMCsec den Auf- und Abbau sowie die Anordnung von Elastin durch Hemmung von Elastasen und dessen Sekretion. In Ex-vivo- Proben führte TGF-β zu einem Abbau der Elastinfasern in der papillären Dermis, während Elastin in Narben als ungerichtete und unstrukturierte Komponente der extrazellulären Matrix erscheint. PBMCsec verhinderte den durch TGF-β vermittelten Abbau und übermäßigen narbigen Wiederaufbau von Elastin und regulierte zudem Gene, die wesentlich an dessen Umstrukturierung beteiligt sind (Abb. 1). Elastin spielt selbst eine Rolle in der Regulation, Freisetzung und Aktivierung von TGF-β; dessen Hemmung durch PBMCsec könnte daher auch eine Unterbrechung dieser Feedback-Schleife sein.7
Der Nachweis der komplexen antifibrotischen Mechanismen von PBMCsec in Narben legt den Grundstein für eine potenzielle klinische Anwendung zur Verbesserung der Narbenbildung nach Operationen, Unfällen oder Verbrennungsverletzungen. Ein wesentlicher Vorteil von PBMCsec gegenüber anderen Stammzellanwendungen oder der Verwendung des Mediums kultivierter Stammzellen liegt in seiner einfachen Handhabung: PBMCsec kann als gefriergetrocknetes Produkt problemlos im Kühlschrank gelagert und unmittelbar vor der Anwendung in physiologischer Kochsalzlösung resuspendiert werden. Es handelt sich um ein gepooltes Produkt aus zahlreichen Spendern pro Charge, was eine gleichbleibende Qualität, Wirksamkeit und Sicherheit gewährleistet. In einer Phase-I-Studie (MARSYAS I) wurde die Sicherheit von PBMCsec bei der Anwendung auf Hautwunden nachgewiesen.8 Eine Phase-II-Studie untersucht derzeit die Wirksamkeit bei diabetischen Fußwunden (MARSYAS II), wobei die Ergebnisse derzeit noch ausgewertet werden. Bei nachgewiesener Wirksamkeit ist jedoch eine Erweiterung der Indikationsbereiche, einschließlich neuer Studien zur Narbenbildung, in naher Zukunft zu erwarten.
Literatur:
1 Eming SA et al.: Wound repair and regeneration: mechanisms, signaling, and translation. Sci Transl Med 2014; 6(265): 265sr6 2 Lichtenauer M et al.: Secretome of apoptotic peripheral blood cells (APOSEC) confers cytoprotection to cardiomyocytes and inhibits tissue remodelling after acute myocardial infarction: a preclinical study. Basic Res Cardiol 2011; 106(6): 1283-97 3 Lichtenauer M et al.: Intravenous and intramyocardial injection of apoptotic white blood cell suspensions prevents ventricular remodelling by increasing elastin expression in cardiac scar tissue after myocardial infarction. Basic Res Cardiol 2011; 106(4): 645-55 4 Wagner T et al.: Different pro-angiogenic potential of γ-irradiated PBMC-derived secretome and its subfractions. Sci Rep 2018; 8(1): 18016 5 Simader E et al.: Tissue-regenerative potential of the secretome of gamma-irradiated peripheral blood mononuclear cells is mediated via TNFRSF1B-induced necroptosis. Cell Death Dis 2019; 10(10): 729 6 Hacker S et al.: Paracrine factors from irradiated peripheral blood mononuclear cells improve skin regeneration and angiogenesis in a porcine burn model. Sci Rep 2016; 6: 25168 7 Vorstandlechner V et al.: The secretome of irradiated peripheral mononuclear cells attenuates hypertrophic skin scarring. Pharmaceutics 2023; 15(4) 8 Simader E, Traxler D.: Safety and tolerability of topically administered autologous, apoptotic PBMC secretome (APOSEC) in dermal wounds: a randomized phase 1 trial (MARSYAS I). Sci Rep 2017; 7(1): 6216
Das könnte Sie auch interessieren:
Übersicht über Melasmabehandlungen
Das Melasma bleibt eine der hartnäckigsten und am schwierigsten zu behandelnden Hyperpigmentierungen. Aufgrund der chronisch-rezidivierenden Natur stellt es für Betroffene und ...
Minimalinvasive Gesichtsrejuvenation
Die minimalinvasive Gesichtsverjüngung hat sich in den vergangenen Jahren rasant entwickelt. Patienten wünschen sich zunehmend effektive, aber zugleich schonende Methoden, die ohne ...
Neue Wege in der Versorgung grosser Wunden im Kalottenbereich
Grosse Defekte im Bereich der Kopfhaut können dank gesteuerter Geweberegeneration mittels alloplastischer, resorbierbarer Matrix mit dem GREAT-Konzept (Guided Tissue REgeneration by ...