Makrophagen bei rheumatoider Arthritis: Welche Rolle spielen sie?
Bericht: Dr. Felicitas Witte
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Makrophagen wurden lange Zeit für die „Schuldigen“ bei der rheumatoiden Arthritis gehalten, da sie die Entzündung vorantreiben. Mithilfe neuerer Analysetechniken wie Einzelzellsequenzierung und besserer Mikroskopieverfahren ist inzwischen klar, dass Makrophagen nicht nur eine „böse“, sondern auch eine „gute“ Seite haben.
Keypoints
-
Makrophagen haben duale Funktionen, wobei CX3CR1-positive, residente Makrophagen als immunregulatorische Barriere Entzündungen im Synovialgewebe kontrollieren.
-
Die CX3CR1-Makrophagen-Schutzschicht bildet eine physische Abgrenzung der intraartikulären Strukturen und exprimiert immunregulatorische Moleküle wie TREM2, Axl und Mfge8.
-
Während eines entzündlichen Schubs zerfällt die Makrophagenbarriere durch Immunkomplex-vermittelte Aktivierung, was den Entzündungsprozess fördert.
-
Proinflammatorische Monozyten und Makrophagen aus dem Blut von RA-Patienten zeigen einen hyperenergetischen Stoffwechsel mit erhöhter Glykolyse, vermittelt durch STAT3.
-
Die frühen metabolischen Veränderungen in Monozyten und Makrophagen könnten als Biomarker zur Identifikation von Risikopatienten und für gezielte Therapien genutzt werden.
Offenbar gibt es eine Untergruppe von Makrophagen im Synovialgewebe, die antiinflammatorisch wirkt und den ersten Ausbruch und folgende Schübe der Gelenkentzündungen verhindern kann. Einen Überblick über die verschiedenen Makrophagenpopulationen und ihren Einfluss auf die Entzündung gaben auf dem EULAR-Kongress Prof.GerhardKrönke und Dr.Megan Hanlon. Krönke ist Facharzt für Rheumatologie und Leiter der Abteilung für Rheumatologie und Klinische Immunologie in der Charité, Universitätsklinikum Berlin. Hanlon hat einen Bachelor of Science in Biomedical, Health and Life Sciences und forscht als Postdoc in der Abteilung für Rheumatologie, Inflammation und Immunität in der Harvard Medical School sowie in der Abteilung für molekulare Rheumatologie im Trinity College, Dublin.
Sind Gewebemakrophagen die Schuldigen der synovialen Entzündung?
Makrophagen entwickeln sich zum einen aus den im Blut zirkulierenden Monozyten, die während Entzündungen in die betroffenen Gewebe einwandern. Zum anderen gibt es in Geweben auch ortsständige, residente Makrophagen. Im Gehirn werden sie Mikroglia genannt, in der Leber Kupferzellen, im Bindegewebe Histiozyten, in der Lunge sind es die Alveolarmakrophagen, im Knochen die Osteoklasten und in der Haut die Langerhans-Zellen.
Diese residenten Makrophagen besiedeln die Gewebe bereits in der frühen embryonalen Entwicklung und existieren während des Erwachsenenlebens selbstständig und unabhängig von den Blutmonozyten. Es war lange nicht klar, ob diese geweberesidenten Makrophagen Entzündungen vorantreiben oder ob sie immunregulatorisch wirken.
2019 untersuchten Krönke und sein Team die räumliche und zeitliche Verteilung der Makrophagen in gesunden und entzündeten Gelenken anhand von Mausmodellen und beschrieben die verschiedenen Makrophagenpopulationen umfassend.1 Sie fanden heraus, dass die residenten Makrophagen ziemlich heterogen sind und dass sie sich in ihrem Genexpressionsmuster unterscheiden. Vor allem die CX3CR1-positiven Makrophagen zogen die Aufmerksamkeit der Forscher auf sich, denn sie schienen diejenigen zu sein, die immunregulatorisch wirken. Weitere Untersuchungen ergaben, dass die CX3CR1-Makrophagen eine dichte, epithelähnliche Schicht auf der Synovialmembran bilden, und zwar auf den synovialen Fibroblasten. Diese Schicht trennt das Innere des Gelenks mit Synovialflüssigkeit, Knorpel und Knochen vom synovialen Gewebe. Die CX3CR1-positiven Makrophagen exprimieren diverse immunregulatorische Gene und bilden „tight-junctions“, die man normalerweise in Darmepithelzellen und anderen endothelialen Zellen sieht, beispielsweise im Gehirn. „Die Zellen zeigen also Eigenschaften, die ansonsten typisch sind für epitheliale Zellen“, erklärt Krönke. „Sie bilden somit eine immunologische Barriere an der Synovialmembran und kapseln das Gelenk physisch ab.“
Die Zahl dieser CX3CR1-positiven ortsansässigen Makrophagen bleibt durch einen Pool von lokal proliferierenden CX3CR1-negativen mononukleären Zellen, die in das synoviale Gewebe eingebettet sind, konstant. Anders als Makrophagen, die sich aus Monozyten entwickeln, zum Ort der Entzündung einwandern und aktiv zur Gelenkentzündung beitragen, limitieren die epithelähnlichen, ortsansässigen, CX3CR1-positiven Makrophagen die entzündliche Reaktion, indem sie ein „Schutzschild“ für die intraartikulären Strukturen bilden.
Makrophagenbarriere löst sich auf
Mit weiteren Mausmodellen stellten Krönke und sein Team fest, dass im Normalzustand die Menge der CX3CR1-positiven Makrophagen, die die Schutzschicht bilden, und die der CX3CR1-negativen interstitiellen Makrophagen konstant blieb, unabhängig von der Zahl der Monozyten. Während der induzierten Arthritis trugen zwar die Blut-Monozyten teilweise dazu bei, dass sich die synovialen Makrophagen vermehrten. Dennoch proliferierten und vermehrten sich diese eher eigenständig – insbesondere die interstitiellen CX3CR1-negativen Makrophagen. Die CX3CR1-positiven Makrophagen änderten ihre räumliche Anordnung und Morphologie, blieben aber in ihrer Position. RNA-Sequenzierungen zeigten, dass die Makrophagen zu verschiedenen Populationen gehören und unterschiedliche Gene exprimieren, die jeweils eine spezielle Rolle bei der Immunregulation spielen. So folgt beispielsweise auf die initiale Proliferation der interstitiellen MHCII-positiven, CX3CR1-negativen Makrophagen eine Hochregulierung der mRNA, die für die Transkriptionsfaktoren MAFB und MAF codiert. Beide sind in die Proliferation von Makrophagen involviert. RNA-Sequenzierungen ergaben, dass nach Beginn der Arthritis neue Cluster von mononukleären Makrophagen auftreten, die sich mit dem weiteren Verlauf der Entzündung ausbreiteten. Diese Zellen zeigten starke proinflammatorische Eigenschaften. Die CX3CR1-positiven Makrophagen auf ihrer Schutzschicht behielten dagegen ihren immunregulatorischen Phänotyp – obwohl die Entzündung in ihrer Umgebung immer mehr zunahm. Sie exprimierten große Trem2 (Triggering Receptor Expressed on Myeloid Cells 2) und große Mengen an Rezeptoren, die für die Beseitigung apoptotischer Zellen zuständig sind, beispielsweise Axl (Tyrosinkinase-Rezeptor aus der TAM-Rezeptorfamilie) und Mfge8 (Milk Fat Globule-EGF Factor 8).
Neuer Ansatz für Therapien
Im Verlauf der Entzündung – sowohl im Mausmodell als auch beim Menschen – lösten sich die „tight junctions“ zwischen der synovialen Makrophagenschicht rasch auf. MRT-Aufnahmen zeigten, dass diese Auflösung mit einem intraartikulären Einfluss von Kontrastmittel zu Beginn der Arthritis einherging.
Die Auflösung der „tight junctions“ innerhalb der CX3CR1-positiven Makrophagen-Schutzschicht trat als Reaktion auf eine Immunkomplex-vermittelte Aktivierung dieser Makrophagen auf und passierte unabhängig von den inflammatorischen myeloiden Zellen. „All diese Daten weisen darauf hin, dass die CX3CR1-Makrophagen eine wichtige immunregulatorische Funktion haben“, sagt Krönke. „Sie bilden die physische und funktionelle Barriere, die die intraartikulären Strukturen abgrenzt sowie schützt und so den Beginn der Entzündung kontrolliert. Das könnte den Weg ebnen für neue therapeutische Ansätze.“ So wurde beispielsweise gezeigt, dass der Tyrosinkinasehemmer Imatinib die Bildung von „tight junctions“ an der Blut-Hirn-Schranke stabilisieren und möglicherweise den Beginn einer Arthritis hinauszögern kann. Krönke könnte sich auch vorstellen, die beeinträchtigte Makrophagenbarriere zu regenerieren. „Das ist aber noch weit entfernte Zukunftsmusik.“
In einer aktuellen, noch nicht veröffentlichten Studie2 wies Krönkes Team nach, dass die Fibroblasten eine große Rolle im Entzündungsprozess spielen. Die Fibroblasten scheinen die Entzündung „anzustoßen“, was zu einem Bruch der synovialen Makrophagenbarriereschicht führt. Krönkes Team zeigte, dass die Fibroblasten eng mit den residenten Makrophagen in ihrer Barriereschicht kommunizieren und sich gegenseitig beeinflussen. In späteren Stadien der Gelenkentzündung werden die Fibroblasten dominant, zudem infiltrieren Monozyten aus der Gelenkhöhle das Gewebe und treiben den Entzündungsprozess voran.
Sind Makrophagen aus Blut-Monozyten die Schuldigen der synovialen Entzündung?
Dass Makrophagen sehr wohl eine Rolle bei der rheumatoiden Arthritis spielen, führte Dr. Hanlon aus. Makrophagen hätten eine Schlüsselrolle bei der Entzündung inne. Sie produzieren große Mengen proinflammatorischer Zytokine wie TNF-alpha. Darüber hinaus korreliert die Anzahl der Makrophagen mit der Krankheitsaktivität. Dennoch kommt es auf die Art der Makrophagen an. Auch Hanlon betonte, dass man beachten müsse, woher die Makrophagen kämen: Entweder entwickeln sie sich aus den zirkulierenden Monozyten im Blut, die aus Vorläuferzellen aus dem Knochenmark stammen, oder sie entwickeln sich früh während der Embryonalzeit und leben als gewebeständige Makrophagen. Hanlon wollte herausfinden, ob die Immunzellen bereits im Blut für ihre spätere Funktion geprägt werden.
Forscher der University of Stanford hatten bereits 2016 gezeigt, dass die Monozyten und Makrophagen zum Entzündungsprozess einer atherosklerotischen koronaren Herzkrankheit beitragen.3 In dieser Studie nutzten Monozyten und Makrophagen übermässig Glukose, was infolgedessen zu einer exzessiven und verlängerten Produktion von Interleukin-6 und Interleukin-1ß führte und somit die systemische und lokale Entzündung vorantrieb. Eine erhöhte Glukoseaufnahme in die Zellen fördert die Bildung mitochondrialer reaktiver Sauerstoffradikale. Diese wiederum aktivieren das glykolytische Enzym Pyruvatkinase M2 und boostern letztlich über den Transkriptionsfaktor STAT3 die Produktion von IL-6 und IL-1. Diesen Effekt wollte Hanlon im Hinblick auf die rheumatoide Arthritis (RA) untersuchen. Dafür verwendeten Hanlon und ihr Team Monozyten aus dem Blut von Patienten mit RA sowie von gesunden Menschen.4
Drei Subgruppen von zirkulierenden Monozyten existieren:
-
der klassische Typ (CD14-CD16+),
-
der intermediäre CD14+CD16+) und
-
der nicht klassische Typ (CD14-CD16-).
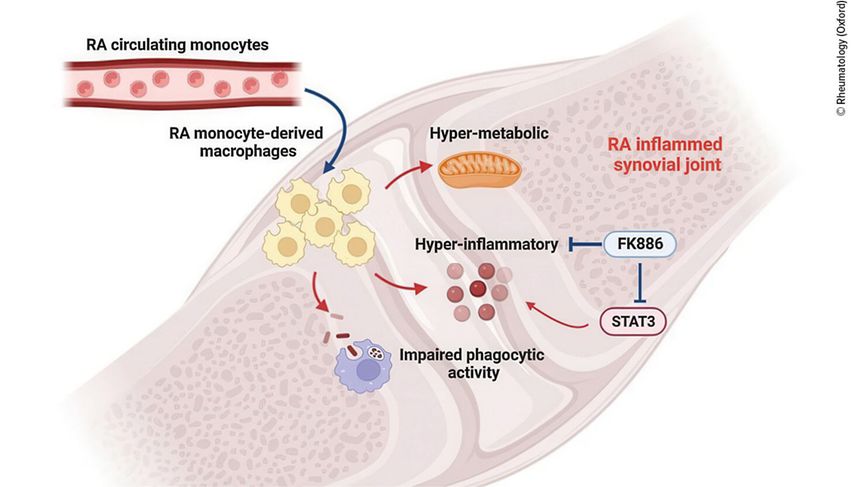
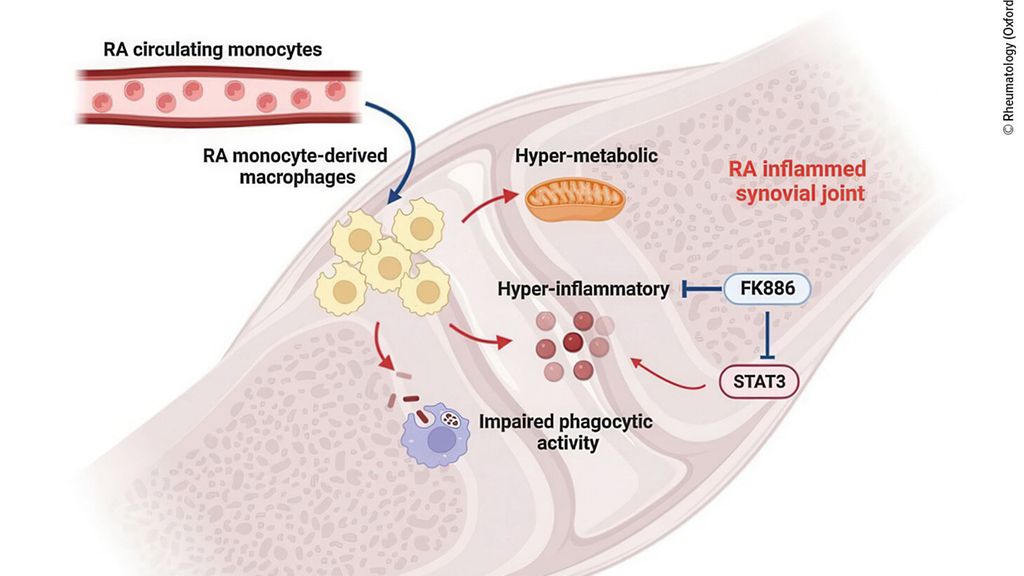
Bei Patienten mit RA zeigte sich ein deutlicher Anstieg der Monozyten vom intermediären Typ(Abb. 1) – Hanlon konzentrierte sich auf die CD14+ Monozyten. Die Monozyten der RA-Patienten waren „hyperinflammatorisch“, erkennbar an proinflammatorischen Genen. Folglich exprimierten sie deutlich mehr proinflammatorische Zytokine als die Monozyten gesunder Menschen. Darüber hinaus zeigten sie einen hyperenergetischen Stoffwechsel mit deutlicher Zunahme an oxidativer Phosphorylierung und Glykolyse4, 5 – durch STAT3 getriggert. Wurde STAT3 gehemmt, führte dies zu einer deutlichen Abnahme der Expression proinflammatorischer Gene in den RA-Makrophagen. Der hyperinflammatorische Monozyten-Phänotyp scheint also abhängig von STAT3 zu sein.
Abb. 1: Zirkulierende CD14+ Monozyten gelangen in die entzündete RA-Synovialis und differenzieren sich zu Makrophagen, die aus Monozyten stammen. Diese Makrophagen prägen sich den Phänotyp ihrer zirkulierenden Vorläuferzellen ein und weisen ein hyperinflammatorisches und hypermetabolisches Profil auf. Interessanterweise zeigen entzündliche Makrophagen auch eine beeinträchtigte Phagozytoseaktivität (mod. nach Hanlon M et al.)3
Makrophagen sind hyperinflammatorisch und hyperenergetisch
Im Rahmen der Entzündung bei der RA kommt es zu einer Hypoxie im Gewebe und zu einer „bioenergetischen Krise“. Diese ist gekennzeichnet durch erhöhte Angiogenese, Aktivierung von Immunzellen, synoviale Invasion, mitochondriale Dysfunktion und veränderten Stoffwechsel. Einige Zellen ändern infolgedessen ihren Stoffwechsel von einem stabilen, ruhenden, zu einem aktivierten Metabolismus, mit vermehrter Glykolyse. Auch, um sich an die veränderten Bedingungen anzupassen. „Die Zellen sind dann in einem hyperenergetischen Stadium“, erklärte Hanlon. Auch wenn man den „Boost“ in zwei Stoffwechselpfaden sieht – nämlich während der oxidativen Phosphorylierung und Glykolyse – scheint die Glykolyse eine bedeutendere Rolle zu spielen: Die RA-Monozyten zeigten eine Zunahme von glykolytischen Schlüsselenzymen wie HIF1α, HK2 und PFKFB3 und waren vom Glukoseverbrauch abhängig. Wurde die Glykolyse gestoppt, wurde auch der proinflammatorische Zytokinanstieg unterbrochen.5
In weiteren Versuchen zeigte Hanlons Team, dass die Makrophagen, die sich aus den inflammatorischen CD14+ Monozyten mit verändertem Stoffwechsel entwickeln, den inflammatorischen Phänotyp und auch den metabolischen, hyperenergetischen Phänotyp ihrer inflammatorischen Vorgängerzellen beibehalten.4 Die inflam-matorischen RA-Makrophagen zeigten zudem eine gestörte Phagozytose im Vergleich zu den ruhenden, nicht inflammatorischen Makrophagen. „Das weist darauf hin, dass die inflammatorische Eigenschaft die Phagozytose beeinträchtigt“, sagte Hanlon.
Hyperinflammation und Hypermetabolismus in Monozyten und Makrophagen scheinen schon sehr früh im Verlauf der RA aufzutreten, wie Hanlons Team bei Patienten mit erhöhtem Risiko für und verschiedenem Schweregrad von RA zeigte. Sie treten offenbar bereits auf, noch bevor klinische Symptome zu erkennen sind.5 Mit zunehmendem Krankheitsverlauf nahmen der inflammatorische und hyperenergetische Zustand der Zellen zu. „Die hyperinflammatorische und hyperenergetische Signatur sehen wir sehr früh im Verlauf der Krankheit, und wir könnten damit Personen mit einem erhöhten Risiko identifizieren“, spekulierte Hanlon.
Ob und inwiefern die Makrophagen in Zukunft als Biomarker oder gar als therapeutischer Ansatz bei der rheumatoiden Arthritis dienen, wird sich zeigen.
Quelle:
Symposium während des EULAR-Kongresses: Basic and Translational Science: „Macrophages in Rheumatoid Arthritis: again and again“. 13. Juni 2024, Wien
Literatur:
1 Culemann S et al. Locally renewing resident synovial macrophages provide a protective barrier for the joint. Nature 2019; 572(7771): 670-5 2 Knab K et al.: unpublished 3 Shirai T et al.: The glycolytic enzyme PKM2 bridges metabolic and inflammatory dysfunction in coronary artery disease. J Exp Med 2016; 213(3): 337-54 4 Hanlon MM et al.: Rheumatoid arthritis macrophages are primed for inflammation and display bioenergetic and functional alterations. Rheumatology (Oxford) 2023; 62: 2611-20 5 McGarry T et al.: Synovial fibroblasts: a pivotal role in the pathogenesis of rheumatoid arthritis. Clin Transl Immunology 2021; 10(3): e1237
Das könnte Sie auch interessieren:
Mehr kardiovaskuläre Ereignisse und Malignome?
Mit Tofacitinib, einem Strukturanalogon von ATP, wurde 2013 erstmals ein Januskinase-Inhibitor (JAKi) in der Schweiz zugelassen. Die Vertreter dieser Medikamentenklasse haben sich gut ...
Seltene Kleingefässvaskulitiden im Fokus
Bei Vaskulitiden der kleinen Gefässe liegt eine nekrotisierende Entzündung der Gefässwand von kleinen intraparenchymatösen Arterien, Arteriolen, Kapillaren und Venolen vor. Was gilt es ...
Elektive Hüft-TEP bei Adipositas Grad III
Übergewichtige Patient:innen leiden früher als normalgewichtige Personen an einer Hüft- oder Kniearthrose. Allerdings sieht die aktuelle S3-Leitlinie zur Behandlung der Coxarthrose in ...