Demenz, Depression und Schizophrenie
Bericht:
Dr. rer. nat. Torsten U. Banisch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In den letzten Jahren konnten die Erkenntnisse über die molekularen Grundlagen neurologisch-psychiatrischer Leiden wie Alzheimerdemenz, Depression und Schizophrenien stark erweitert werden. So wurden nicht nur neue Biomarker für Krankheitsverläufe identifiziert, sondern auch alternative Therapiekonzepte entwickelt, die in diesen Behandlungsfeldern stetig zu Verbesserungen führen.
Genetische Grundlagen und neue Ansätze in der Demenztherapie
„Neben den bekannten Risikofaktoren für eine Alzheimererkrankung, wie kardiovaskuläre Auffälligkeiten oder Tabak- und Alkoholkonsum, sind die Ursachen der Demenz in genetischen Veränderungen zu suchen“, eröffnete Univ.-Prof. Dr. Dan Rujescu von der Medizinischen Universität Wien seinen Vortrag. Vor allem seltene genetische Varianten tragen grundlegend zur Ausprägung der Erkrankung bei.1 Dies wurde bereits 1993 an Apolipoprotein-E(ApoE)-Genotypen gezeigt, die mit einem erhöhten Alzheimerrisiko (10–55%) assoziiert waren.2 Dank genomweiter Studien konnten etwa 100 weitere krankheitsassoziierte Gene identifiziert werden.3,4 Die funktionelle Charakterisierung dieser Gene zeigte, dass sie Prozesse regulieren, die mit der Beseitigung apoptotischer Zellen/Partikel durch Mikroglia in Zusammenhang stehen (Efferozytose).5 Durch die Studien konnten zudem biologische Marker identifiziert werden, die erste Anzeichen einer Alzheimererkrankung bereits 20 Jahre vor dem Auftreten kognitiver Demenzsymptome zeigen können.6,7
Diese Erkenntnisse unterstützten die Entwicklung zielgerichteter Behandlungsansätze: Zwei monoklonale Antikörper, die sich gegen Amyloid-β(Aβ)-Plaques richten (Lecanemab, Donanemab), konnten bereits Verbesserungen bei der Kognition und Funktionsfähigkeit erzielen.8,9 Die EU-Zulassungsanträge für beide Therapieoptionen werden zurzeit geprüft. Die rezente Phase-II-Studie INVOKE-2 untersucht den Nutzen des Antikörpers AL002, der sich gegen den selektiv auf Mikroglia exprimierten Rezeptor TREM2 richtet. Ziel ist es, so Mikroglia zu aktivieren und die Aβ-Phagozytose zu erhöhen. Erste Daten werden für 2025 erwartet.10
Für Patient:innen, die nicht mit Antikörpern behandelt werden können,stehen mit Acetylcholinesterasehemmern, Memantin und EGb 761, einem Spezialextrakt aus Ginkgo biloba, Therapiealternativen zur Verfügung. EGb761 erhöht hierbei nachweislich den Gehalt an Neurotransmittern im präfrontalen Kortex und die neuronale Plastizität. Zudem wird die Viskosität des Blutes reduziert und dadurch die Blutzirkulation verbessert.11,12
Die Behandlung zeigte bereits bei leichter bis mittelschwerer Demenz und bei milden kognitiven Symptomen einen therapeutischen Nutzen und eine gute Verträglichkeit.13,14 Zudem besteht ein Zusammenhang zwischen wiederholter EGb-761-Gabe und einem verbesserten Demenzschutz. Diese positiven Daten führten zu einer Aufnahme der Behandlung in EU-Leitlinien.15,16
Depressionsbehandlung verbessert
„Unbehandelte Patient:innen mit Depression haben ein 20-fach höheres Risiko für einen Suizidversuch im Vergleich zu gesunden Menschen. Eine Behandlung der Depression führt bereits zu einem 3-fach niedrigeren Risiko im Vergleich zu unbehandelten Patient:innen“, erörtert Ap. Prof. DDr. Christoph Kraus von der Medizinischen Universität Wien.17,18 Es ist also wichtig, frühzeitig Maßnahmen zu ergreifen. Zu den längerfristigen Maßnahmen zählt die Verhaltenstherapie, die Suizidalität um 50–60% verringert.19 Ähnliche Erfolge wurden auch mit Clozapin und Lithium erzielt.20,21 Bei leichten Episoden ist die Psychotherapie Mittel der ersten Wahl und sollte bei allen anderen Verläufen als Erhaltungstherapie mitverordnet werden.
Ein generelles Problem in der Depressionsbehandlung, v.a. bei schweren Depressionen, ist die Tatsache, dass die Anzahl der Patient:innen, die auf spätere Behandlungslinien ansprechen, stetig abnimmt und 13–25% wenig bis kaumansprechen. In der ersten Behandlungslinie stehen Monotherapien und Dosiseskalationen (unter anderem Serotonintransporter oder Dopamintransporter-Wiederaufnahme-Inhibitoren) zur Verfügung, auf die bis zu 50% der Patient:innen ansprechen. In der zweiten Linie sind eine Augmentation (Quetiapin, Olanzapin, Aripiprazol, Lithium), Kombinationstherapien oder bei schwerer depressiver Störung auch eine Elektrokonvulsionstherapie eine Option. Ab der dritten Linie wird es zunehmend schwerer, geeignete Therapien zu finden. Hier werden alternative Ansätze aus den vorhergehenden Behandlungslinien oder experimentelle Ansätze wie die Vagusnervstimulation herangezogen.22
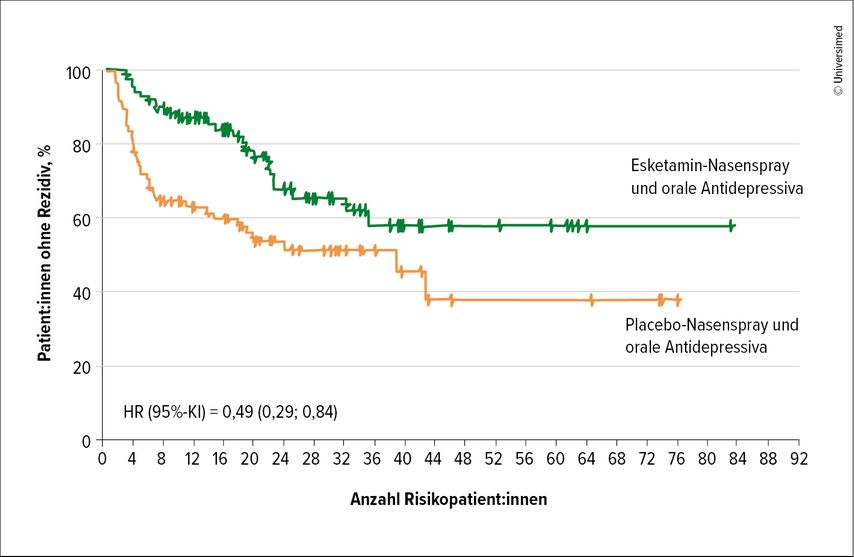
Für neue Behandlungsansätze kam die Balance von Glutamat und GABA in den Fokus, da diese bei einer Depression gestört ist, was Auswirkungen auf die Plastizität im Gehirn hat. Der glutamaterge Modulator Ketamin erhöhte hier kurzfristig den Glutamatspiegel und erreichte eine Wiederannäherung an das natürliche Gleichgewicht.23 „Ketamin hat uns in der Depressionsbehandlung ein komplett neues Bild eröffnet“, so Prof. Kraus. Hier sind innerhalb von Stunden klinische Ansprechraten bei bis zu 60% der Patient:innen zu sehen und eine signifikante Reduktion der Suizidalitätist möglich.24 Auch die Daten aus der SUSTAIN1-Studie (n=297) zu einer Erhaltungstherapie mit Esketamin plus Antidepressiva sind positiv, mit einer 51%igen Reduktion des Rezidivrisikos gegenüber einer alleinigen Antidepressivatherapie bei Patient:innen mit behandlungsresistenter Depression (Abb.1).25
Abb. 1: Esketamin reduziert das Rezidivrisiko bei schwerer Depression (mod. nach Daly et al. 2019)25
Generell haben schnell wirksame Antidepressiva die Behandlung verändert, mit Fortschritten nicht nur bei den glutamatergen Therapien, sondern auch mit Neuentwicklungen bei Opioiden und serotoninergen Modulatoren, die zukünftig das Therapiefeld erweitern sollten.22
Langzeitdepottherapie der Schizophrenie
Am Anfang einer Schizophrenie treten Episoden von Psychosen auf, die schließlich in einen gleichbleibenden, verschlechterten Zustand (Residuum) übergehen, der Jahrzehnte lang anhalten kann. Lediglich 14% der Patient:innen können nach der psychotischen Phase ansatzweise an ihr prämorbides Funktionsniveau anschließen, die meisten zeigen eine deutlich verminderte Funktionalität.26 „Das zentrale Ziel der Therapierung ist daher die Funktionserhaltung“, erklärt Prim. Dr. Georg Psota, Chefarzt der Psychosozialen Dienste in Wien. Die Grundvoraussetzungen hierfür sind eine frühe Intervention, Psychoedukation, die kognitive Verhaltenstherapie, das Training sozialer Fähigkeiten und besonders eine konstante medikamentöse Behandlung.
Die Folgen von Nonadhärenz bei Schizophrenie sind weitreichend, mit einer dramatischen Erhöhung von Gewalt gegen sich und/oder andere, einer Verschlechterung somatischer Gesundheitsaspekte, vermehrter Alkohol- und Drogenabhängigkeit und folglich einer erhöhten Rezidivrate.27 Der Einsatz von Depotmedikationen verspricht weitreichende Behandlungserleichterungen und die Gewährleistung des Therapienutzens. So kommen vermehrt lang wirksame injizierbare Antipsychotika (LAI) zum Einsatz, die eine Wirkdauer von 2–24 Wochen haben.28
„Gerade Dauern über mehrere Monate sollten jedoch kritisch betrachtet werden, da diese Patient:innen in regelmäßigen Abständen Kontrollen brauchen“, so Prim. Psota. Aus Sicht der Patient:innen verbessert das Depot die Lebensqualität, da es weniger aufwendig ist, die Behandlungen zu planen, die Langzeitwirkung eine gewisse Behandlungssicherheit gibt und sie weniger oft an ihre Krankheit erinnert werden.
Für behandelnde Ärzt:innen steht die verbesserte Therapiegewährleistung an erster Stelle. Zudem besteht eine Unabhängigkeit, was die Pharmakokinetik und Einnahmeanforderungen angeht, und auch die Rehospitalisierungsraten sind geringer. Jedoch ist die Variationsmöglichkeit bei den Depots begrenzt und Patient:innen können die Anwendung und deren Nebenwirkungen als unangenehm oder schmerzhaft empfinden oder stoßen sich an der Fremdbestimmung ihrer Behandlung.
„Trotz der klaren Vorteile ist die Rate an Depotverschreibungen immer noch gering“, klagt Prim. Psota. Mögliche Gründe hierfür liegen in dem höheren Zeitaufwand bei der Aufklärung. Oft schreckt auch die vermeintliche Komplexität der Behandlung ab. Um im Therapiefeld der Schizophrenien wirkungsvolle und auch lang anhaltende Erfolge zu erzielen, muss jedoch dringend ein Sinneswandel erfolgen.
Negativ- und kognitive Symptome
„Patient:innen mit einer Schizophrenie weisen spezifische kognitive Beeinträchtigungen auf“, erläutert Prim. PD Dr. Andreas Erfurth von der Klinik Hietzing in Wien. Zu den Domänen der Kognition zählen logisches Denken und Problemlösung, die Verarbeitungsgeschwindigkeit, visuelles und verbales Lernen und Gedächtnis, das Arbeitsgedächtnis, Aufmerksamkeit und Vigilanz und die soziale Kognition.29,30 Im klinischen Setting können diese Parameter durch Fragenkataloge wie den circa 10-minütigen „Screen for Cognitive Impairment in Psychiatry“ (SCIP) erfasst werden. Dieser beinhaltet unmittelbare und verzögerte Lerntests, Tests zum Arbeitsgedächtnis, zur verbalen Flüssigkeit und zur Verarbeitungsgeschwindigkeit.31 Der Test kann auch zur Überprüfung von Therapiefortschritten im klinischen Setting eingesetzt werden.32
Modulation der NMDAR-Aktivität
Da es keine zugelassenen Medikamente zur Behandlung einer kognitiven Beeinträchtigung in Zusammenhang mit Schizophrenie (CIAS) gibt, sind neuartige Behandlungsoptionen und/oder -mechanismen für die gezielte pharmakologische Behandlung von CIAS erwünscht.
Der N-Methyl-D-Aspartat(NMDA)-Rezeptor ist ein vielversprechendes Ziel, da er eine Rolle bei der Kognition spielt. So konnte eine NMDA-Rezeptorhypofunktion mit der kognitiven Beeinträchtigung bei Schizophrenie assoziiert werden.33 Hier setzt die Wirkungsweise des selektiven Glycin-Transporter1-(GlyT1)-Inhibitors Iclepertin an, der dieGlycinkonzentration im synaptischen Spalt von glutamatergen Neuronen steigert und somit die Funktion des NMDA-Rezeptors verstärkt.34 In einer Phase-II-Studie zur Wirksamkeit und Sicherheit von Iclepertin bei Erwachsenen mit Schizophrenie (n=509)wurde über 12 Wochen eine Verbesserung in der Kognition im Vergleich zur Baseline beobachtet.35 Diese positiven Daten waren der Ausgangspunkt für das Phase-III-Programm CONNEX (n=1840), das aus 3 Studien weltweit besteht.36 Die CONNEX-X-Studie untersucht zurzeit die Langzeitsicherheit von Iclepertin über einen Zeitraum von 52 Wochen (n=1401).37
Somit könnte die gezielte Beeinflussung des glutamatergen Systems ein gutes Ziel für die Entwicklung einer Pharmakotherapie der CIAS sein.
Quelle:
Interdisziplinäres Herbstsymposium für Psychopharmakologie und Neurologie, 5. Oktober 2024 in Wien
Literatur:
1 McCarthy MI et al.: Genome-wide association studies for complex traits: consensus, uncertainty and challenges. 2008; 9(5): 356-69 2 Strittmatter WJ et al.: Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease. PNAS 1993; 90(5): 1977-81 3 Harold D et al.: Genome-wide association study identifies variants at CLU and PICALM associated with Alzheimer’s disease. Nat Genet 2009; 41(10): 1088-93 4 Kunkle BW et al.: Genetic meta-analysis of diagnosed Alzheimer’s disease identifies new risk loci and implicates Aβ, tau, immunity and lipid processing. Nat Genet 2019; 51(3): 414-30 5 Andrews SJ et al.: The complex genetic architecture of Alzheimer’s disease: novel insights and future directions. EBioMedicine 2023; 90: 104511 6 Fišar Z et al.: Linking the amyloid, tau, and mitochondrial hypotheses of Alzheimer’s disease and identifying promising drug targets. Biomolecules 2022; 12(11): 1676 7 Shen Y et al.: CSF proteomics identifies early changes in autosomal dominant Alzheimer’s disease. Cell 2024; 187(22): 6309-26 8 Van Dyck CH et al.: Lecanemab in early Alzheimer’s disease. N Engl J Med 2023; 388(1): 9-21 9 Sims JR et al.: Donanemab in early symptomatic Alzheimer disease: the TRAILBLAZER-ALZ 2 randomized clinical trial. JAMA 2023; 330(6): 512-27 10 ClinicalTrials.gov ID: NCT04592874 11 Yoshitake T et al.: The ginkgo biloba extract EGb 761(R) and its main constituent flavonoids and ginkgolides increase extracellular dopamine levels in the rat prefrontal cortex. Br J Pharmacol 2010; 159(3): 659-68 12 Fehske CJ et al.: Ginkgo biloba extract (EGb761) influences monoaminergic neurotransmission via inhibition of NE uptake, but not MAO activity after chronic treatment. Pharmacol Res 2009; 60(1): 68-73 13 Ihl R et al.: Efficacy and safety of a once-daily formulation of Ginkgo biloba extract EGb 761 in dementia with neuropsychiatric features: a randomized controlled trial. Int J Geriatr Psychiatry 2011; 26(11): 1186-94 14 Hort J et al.: Ginkgo biloba Extract EGb 761 in the treatment of patients with mild neurocognitive impairment: a systematic review. Neuropsychiatr Dis Treat 2023; 19: 647-60 15 Bohlken J et al.: Association between ginkgo biloba extract prescriptions and dementia incidence in outpatients with mild cognitive impairment in Germany: a retrospective cohort study. JAlzheimers Dis 2022; 86(2): 703-9 16 S3-Leitlinie: Demenzen 2016 17 Suizid und Suizidprävention in Österreich, BMSGPK 2019 18 Lecrubier Y et al.: Physician observations and perceptions of positive and negative symptoms of schizophrenia: a multinational, cross-sectional survey. Eur Psychiatry 2007; 22(6): 371-9 19 Brown GK et al.: Effectiveness of cognitive behavioral therapy for veterans with depression and suicidal ideation. Arch Suicide Res 2016; 20(4): 677-82 20 Masdrakis VG et al.: Prevention of suicide by clozapine in mental disorders: systematic review. Eur Neuropsychopharmacol 2023; 69: 4-23 21 Nabi Z et al.: Effects of lithium on suicide and suicidal behaviour: a systematic review and meta-analysis of randomised trials. Epidemiol Psychiatr Sci 2022; 31: e65 22 Kraus C et al.: Prognosis and improved outcomes in major depression: a review. Transl Psychiatry 2019; 9(1): 127 23 Wierońska JM et al.: Metabotropic glutamate receptors in the tripartite synapse as a target for new psychotropic drugs. Neurochem Int 2009; 55(1-3): 85-97 24 Fu DJ et al.: Esketamine nasal spray for rapid reduction of major depressive disorder symptoms in patients who have active suicidal ideation with intent: double-blind, randomized study (ASPIRE I). J Clin Psychiatry 2020; 81(3): 19m13191 25 Daly EJ et al.: Efficacy of esketamine nasal spray plus oral antidepressant treatment for relapse prevention in patients with treatment-resistant depression: a randomized clinical trial. JAMA Psychiatry 2019; 76(9): 893-903 26 Birchwood M et al.: Early intervention in psychosis. The critical period hypothesis. Br J Psychiatry Suppl 1998; 172(33): 53-9 27 Robinson D et al.: Predictors of relapse following response from a first episode of schizophrenia or schizoaffective disorder. Arch Gen Psychiatry 1999; 56(3): 241-7 28 Biagi E et al.: Long-acting injectable antipsychotics in schizophrenia: literature review and practical perspective, with a focus on aripiprazole once-monthly. Adv Ther 2017; 34(5): 1036-48 29 Carbon M et al.: Thinking and acting beyond the positive: the role of the cognitive and negative symptoms in schizophrenia. CNS Spectr 2014; 19(Suppl 1): 38-52 30 Bora E et al.: Cognitive impairment in schizophrenia and affective psychoses: implications for DSM-V criteria and beyond. Schizophr Bull 2010; 36(1): 36-42 31 Sachs G et al.: Screening for cognitive impairment in schizophrenia: Psychometric properties of the German version of the Screen for Cognitive Impairment in Psychiatry (SCIP-G). Schizophr Res Cogn 2021; 25: 100197 32 MaihoferEIJ et al.: Cognitive function in patients with psychotic and affective disorders: effects of combining pharmacotherapy with cognitive remediation. J Clin Med 2024; 13(16): 4843 33 Lin CH et al.: Glutamate signaling in the pathophysiology and therapy of schizophrenia. Pharmacol Biochem Behav 2012; 100(4): 665-77 34 Rosenbrock H et al.: Effects of the glycine transporter-1 inhibitor Iclepertin (BI 425809) on sensory processing, neural network function, and cognition in animal models related to schizophrenia. J Pharmacol Exp Ther 2022; 382(2): 223-32 35 Fleischhacker WW et al.: Efficacy and safety of the novel glycine transporter inhibitor BI 425809 once daily in patients with schizophrenia: a double-blind, randomised, placebo-controlled phase 2 study. Lancet Psychiatry 2021; 8(3): 191-201 36 Falkai P et al.: Efficacy and safety of iclepertin (BI 425809) in patients with schizophrenia: CONNEX, a phase III randomised controlled trial programme. Eur Psychiatry 2023; 66(Suppl 1): S637 37 ClinicalTrials.gov ID: NCT04846868
Das könnte Sie auch interessieren:
Therapeutisches Drug-Monitoring (TDM) in der Neuropsychopharmakologie: von der Theorie zur klinischen Routine
Therapeutisches Drug-Monitoring (TDM) verbindet angewandte Pharmakokinetik mit der klinischen Praxis und stellt damit ein wertvolles Instrument der Präzisionsmedizin dar. Absorption, ...
Blut-Hirn-Schranke im Fokus: neue Evidenz für ihre Durchlässigkeit bei Schizophrenie-Spektrum-Störungen
Die Blut-Hirn-Schranke (BHS) steht zunehmend im Zentrum der Forschung zu Schizophrenie-Spektrum-Störungen („schizophrenia spectrum disorders“, SSD).Eine aktuelle Studie der LMU München ...
Ketamin-augmentierte Psychotherapie
Das schnell wirksame Antidepressivum (S-)Ketamin wird bei therapieresistenten Patient:innen effektiv eingesetzt. Als zentrale Komponente eines biphasischen Wirkmechanismus wird für ...