Mukoviszidose – eine Erkrankung mit Prädisposition für Pilzinfektionen
Autor:
Univ.-Prof. Dr. med. habil. Carsten Schwarz
Dekan der Fakultät Medizin
HMU – Health and Medical University Potsdam
Mukoviszidosezentrum
Klinikum Westbrandenburg
Potsdam
E-Mail: carsten.schwarz@hmu-potsdam.de
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Pilzinfektionen stellen eine zunehmende Herausforderung in der Behandlung von Menschen mit Mukoviszidose (zystische Fibrose) dar. Spezifische diagnostische Schritte und therapeutische Besonderheiten spielen hierbei eine wichtige Rolle. In diesem Artikel werden im Speziellen die Epidemiologie, die unterschiedlichen bronchopulmonalen Pilzmanifestationen und deren Risikofaktoren beleuchtet.
Keypoints
-
Bei Menschen mit CF ist die pulmonale Manifestation mit bakterieller Exazerbationeine der wichtigsten Organmanifestationen.
-
Neben der Diagnostik und Therapie in Bezug auf Bakterien rücken Pilzspezies dabei ebenfalls in den Vordergrund, da Pilzinfektionen eine klinisch relevante Rolle bei CF spielen.
-
Pilzinfektionen bei CF sind komplex und reichen von harmloser Kolonisation bis zu lebensbedrohlichen invasiven Mykosen.
-
Die Früherkennung, ein Bewusstsein für Risikofaktoren und eine differenzierte Therapieentscheidung sind essenziell für die erfolgreiche Behandlung.
Epidemiologie der Pilzspezies bei Menschen mit zystischer Fibrose
Bei Menschen mit zystischer Fibrose (CF) ist die pulmonale Manifestation mit ihren bakteriellen Exazerbationen eine der wichtigsten Organmanifestationen, weshalb epidemiologisch vor allem die Bakterien Pseudomonas aeruginosa, Staphylococcus aureus, Haemophilus influenzae, Achromobacter xylosoxidans, Burkholderia-Spezies und viele andere eine wichtige Rolle spielen. Die Wichtigkeit wird durch die Neuauflage der S3-Leitlinie „Lungenerkrankung bei Mukoviszidose: Pseudomonas aeruginosa“ verdeutlicht.1 Klinisch erfolgen dementsprechend bei Infektionen primär eine Diagnostik und eine Therapie in Bezug auf Bakterien.
Dabei wird häufig der Nachweis von Pilzen im Respirationstrakt von Menschen mit CF im Sinne einer klinisch relevanten Differenzialdiagnostik vernachlässigt.2,3 Dies hat sich in den letzten Jahren jedoch zunehmend geändert. Pilzspezies rücken bei Diagnostik und Therapie der CF ebenfalls in den Vordergrund. In einer umfassenden Erhebung in 92 deutschen CF-Zentren mit 5665 Patienten wurde deutlich, dass Pilzinfektionen eine klinisch relevante Rolle bei CF spielen. Unter den Sprosspilzen trat mit 42,8% Candida albicans und bei den Fadenpilzen Aspergillus fumigatus mit 27,3% auf. Hierbei war der Nachweis von Aspergillus fumigatus bei Patienten mit CF und Pseudomonas-aeruginosa-negativem Status unter anderem mit einer signifikant verringerten Lungenfunktion (FEV1: –2,54%) und einer erhöhten Rate schwerer pulmonaler Exazerbationen (1,71-fache Zunahme) verbunden. Des Weiteren ist es epidemiologisch und pathophysiologisch interessant, dass auch seltene Pilze wie Exophiala-Spezies, Scedosporium apiospermum und Lomentospora in dieser Studie nachgewiesen werden konnten.4 Diese Befunde verdeutlichen die Notwendigkeit eines gezielten Monitorings und einer frühzeitigen Therapie. Jedoch sind weltweit nicht die gleichen diagnostischen Methoden vorhanden, und therapeutische Ansätze unterscheiden sich ebenfalls in den Ländern.5 Wichtig wären hier internationale Leitlinien, die für die unterschiedlichen Pilzmanifestationen gelten müssen, um die bestmögliche Versorgung der Menschen mit CF zu ermöglichen.
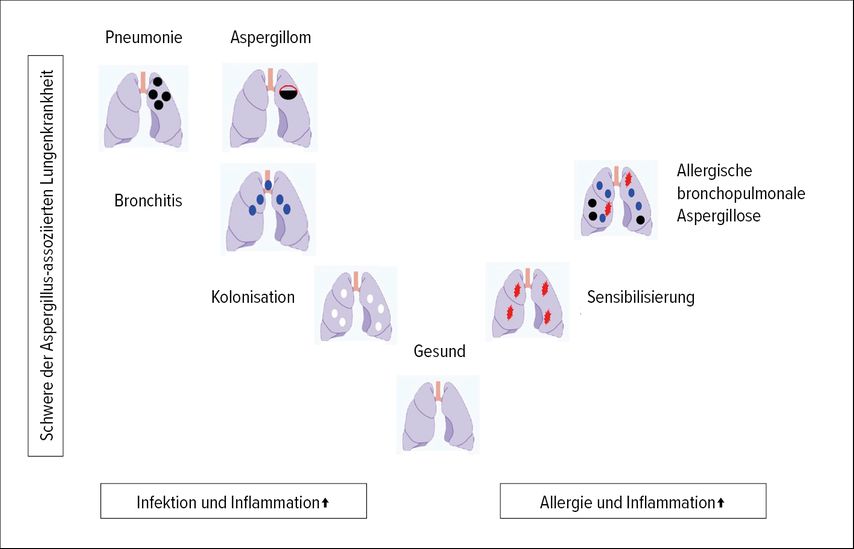
Bezogen auf die Krankheiten bzw. Manifestationen, die durch Pilze in der Lunge und den Atemwegen bei Menschen mit CF verursacht werden können, lassen sich verschiedene Entitäten diagnostizieren, die sich auf zwei immunologische Reaktionen stützen. Zum einen sind Sensibilisierung und allergische bronchopulmonale Aspergillose (ABPA) mit einer allergischen Immunantwort verbunden. Zum anderen sind Kolonisation, Bronchitis und Pneumonie mit einer inflammatorischen Immunantwort assoziiert (Abb. 1). Interessanterweise werden Aspergillome bei Menschen mit CF nicht in der Literatur beschrieben.
Abb. 1: Die pilzbezogenen Kategorien bzw. Entitäten lassen sich vor allem in allergische und nichtallergische unterteilen. Im Schaubild sind typische Manifestationen mit Kolonisation, Bronchitis, Pneumonie und Aspergillom als nichtallergische Manifestationen und Sensibilisierung, allergische bronchopulmonale Aspergillose als allergische Manifestation dargestellt
Kategorien der Pilzmanifestationen
Kolonisation
Der einfache Nachweis ohne Symptome bleibt häufig ohne unmittelbare Konsequenz, kann jedoch ein Risikofaktor für eine spätere Infektion oder auch für eine allergische Reaktion im Sinne einer allergischen bronchopulmonalen Aspergillose sein.2,3
Sensibilisierung
Die einfache Sensibilisierung ohne Nachweis von Symptomen ist meist harmlos. Menschen mit CF zeigen aber eine deutlich häufigere und höhere TH2-Antwort im Vergleich zur Normalbevölkerung und haben dementsprechend häufig klinisch eine asthmatische Komponente.6 Zusätzlich bedeutet dies auch eine Prädisposition für eine besonders schwerwiegende Komplikation, die allergische bronchopulmonale Aspergillose.2,3
Allergische bronchopulmonale Aspergillose (ABPA)
Die ABPA ist eine immunologisch vermittelte Überempfindlichkeitsreaktion auf Aspergillus spp. mit Bronchiektasie und begleitender systemischer Entzündungsreaktion. Da bei CF häufig eine ABPA entstehen kann, sollten serologische Marker regelmäßig bestimmt werden (Gesamt-IgE, Aspergillus-spezifisches IgE und IgG).5–7 Die Therapie besteht primär aus systemischer Kortikosteroidtherapie und einer Kombination mit antifungaler Medikation.5 Aktuell konnte eine spezifische immunologische Komponente bei der ABPA nachgewiesen werden. Hierbei handelt es sich um eine Aspergillus-fumigatus-spezifische TH17-Antwort bei Menschen mit CF, die eine akute ABPA klinisch diagnostiziert bekommen haben.8 Dies könnte in Zukunft einen Ansatz für monoklonale Antikörper darstellen, die mit deutlich weniger Nebenwirkungen als Kortikosteroide behaftet sein würden.
Fungale Bronchitis
Klinisch zeigt sich eine akute Entzündung der Bronchien, die nicht durch Bakterien hervorgerufen wird und dementsprechend unter einer Antibiotikatherapie weiterhin persistiert. Ist dieses Nichtansprechen auf eine Antibiotikatherapie mit wiederholtem Nachweis von Pilzspezies im Sputum oder in anderem respiratorischem Material in Verbindung mit einer klinisch relevanten Exazerbation vorhanden, sollte eine Pilzbronchitis als Differenzialdiagnose herangezogen werden. Der Verdacht erhärtet sich dann durch die Erhöhung der Aspergillus-spezifischen IgG-Antikörper.7 Die Therapie sollte dann für mindestens zwei Wochen unter Lungenfunktions- und Aspergillus-spezifischen IgG-Kontrollen stattfinden.9
Pulmonale Mykosen
Invasive Pilzinfektionen sind selten, aber bei Menschen mit CF stellen sie eine wichtige Differenzialdiagnose bei einer Pneumonie dar. Pilzpneumonien können besonders schwerwiegend verlaufen, wenn sie nicht erkannt werden. Typische radiologische Muster und der mehrfache, selektive kulturelle Nachweis von Pilzspezies helfen bei der Diagnosestellung.10,11 Auch seltene Pilze wie Spezies vom Scedosporium-apiospermum- und Lomentospora-Komplex können Pilzpneumonien bei CF auslösen und bedürfen aufgrund ihrer ausgeprägten Resistenz gegenüber antifungaler Therapie einer Kombinationstherapie mit 2–3 antifungalen Medikamenten, die vorzugsweise mindestens 3 Monate gegeben werden sollten.10,11
Risikofaktoren
Die Entstehung pilzassoziierter Komplikationen der Lunge und Atemwege wird bei Menschen mit CF von verschiedenen Faktoren beeinflusst.
In Bezug auf die Hostfaktoren besteht neben der Prädisposition durch die Lungenstrukturschädigung mit Bronchiektasen und entzündlich verändertem Gewebe ein immunologischer Shift zu TH2- und TH17-Antworten bei pulmonaler Pilzbesiedlung und -infektion.4,6 Zusätzlich stellen therapieassoziierte Einflüsse wie Breitspektrum- und inhalative Antibiotika und Kortikosteroidtherapien ein erhöhtes Risiko dar.12,13Bei der ABPA ist besonders der Tierkontakt als Risikofaktor hervorzuheben. In mehreren Studien konnte eine signifikante Assoziation zwischen Kontakt zu Tieren und einer ABPA erhoben werden.4,14 Bei einer rezidivierenden oder therapieresistenten ABPA sollte deshalb immer nach Tierkontakt des Patienten gefragt werden. Zusätzlich konnte in einer Studie bei 1000 Menschen mit CF die Großstadt im Vergleich zur ländlichen Region als Risikofaktor für die Kolonisation mit Aspergillus fumigatus herausgearbeitet werden.15
Zur hocheffizienten CFTR-Modulator-Therapie mit Elexacaftor/Tezacaftor/Ivacaftor gibt es erste Studien, die einen Rückgang der immunologischen Antwort auf Pilzspezies zeigen.16,17,18 Hierbei scheint auch eine direkte antifungale Wirkung durch den CFTR-Modulator eine Rolle zu spielen.19 Ob aber auch die Infektionen und Allergien bei Menschen mit CF weniger werden, ist noch nicht mit prospektiven Studien nachgewiesen.
Zusammenfassung
Pilzinfektionen bei CF sind ein komplexes und vielschichtiges Problem. Die Bandbreite reicht von harmloser Kolonisation bis zu lebensbedrohlichen invasiven Mykosen. Frühzeitige Erkennung, ein Bewusstsein für Risikofaktoren und eine differenzierte Therapieentscheidung sind essenziell für die erfolgreiche Behandlung. Immunologische Host-Pathogen-Interactions sind bei Menschen mit CF sehr gut untersucht und ermöglichen eventuell in der Zukunft gezielte Therapieoptionen. Neue Therapieansätze, insbesondere CFTR-Modulatoren, verändern die Infektionsraten, jedoch verlangt die hochkomplexe infektiologische und inflammatorische Gegebenheit der CF weiterhin ein hohes Maß an klinischer Aufmerksamkeit gerade in Bezug auf die klinische Manifestation von pulmonalen Pilzerkrankungen.
Literatur:
1 Schwarz C et al.: CF lung disease – a German S3 guideline: pseudomonas aeruginosa. Pneumologie 2024; 78(6): 367-99 2 Schwarz C: Clinical relevance of fungi in cystic fibrosis. Semin Respir Crit Care Med 2023; 44(2): 252-9 3 Schwarz C et al.: Pulmonary aspergillosis in people with cystic fibrosis. Semin Respir Crit Care Med 2024; 45(1): 128-40 4 Düesberg U et al.: Risk factors for respiratory Aspergillus fumigatus in German cystic fibrosis patients and impact on lung function. Sci Rep 2020; 10(1): 18999 5 Hong G et al.: Clinician variability in the diagnosis and treatment of Aspergillus fumigatus-related conditions in cystic fibrosis: an international survey. J Cyst Fibros 2022; 21(1): 136-42 6 Schwarz C et al.: Antigen specificity and cross-reactivity drive functionally diverse anti-Aspergillus fumigatus T cell responses in cystic fibrosis. J Clin Invest 2023; 133(5): e161593 7 Eschenhagen P et al.: Prospective evaluation of Aspergillus fumigatus-specific IgG in patients with cystic fibrosis. Front Cell Infect Microbiol 2021; 10: 602836 8 Bacher P et al.: Human anti-fungal Th17 immunity and pathology rely on cross-reactivity against candida albicans. Cell 2019; 176(6): 1340-55.e15 9 Brandt C et al.: Aspergillus bronchitis in patients with cystic fibrosis. Mycopathologia 2018; 183(1): 61-9 10 Schwarz C et al.: Invasive pulmonary fungal infections in cystic fibrosis. Mycopathologia 2018; 183(1): 33-43 11 Schwarz C et al.: Combined antifungal therapy is superior to monotherapy in pulmonary scedosporiosis in cystic fibrosis. J Cyst Fibros 2019; 18(2): 227-32 12 Hong G et al.: Risk factors for persistent Aspergillus respiratory isolation in cystic fibrosis. J Cyst Fibros 2018; 17(5): 624-30 13 Hong G et al.: Inhaled antibiotic use is associated with Scedosporium/Lomentospora species isolation in cystic fibrosis. Pediatr Pulmonol 2019; 54(2): 133-40 14 Grehn C et al.: Frequent pet contact as risk factor for allergic bronchopulmonary aspergillosis in cystic fibrosis. Front Cell Infect Microbiol 2021; 10: 601821 15 Grehn C et al.: Urban life as risk factor for aspergillosis. Front Cell Infect Microbiol 2020; 10: 601834 16 Lanfranchi C et al.: Respiratory outcomes and Aspergillus serology following Elexacaftor/Tezacaftor/Ivacaftor therapy in people with cystic fibrosis and a history of Aspergillus fumigatus infection. Lung 2025; 203(1): 24 17 Chatterjee P et al.: Allergic bronchopulmonary aspergillosis (ABPA) in the era of cystic fibrosis transmembrane conductance regulator (CFTR) modulators. J Fungi (Basel) 2024; 10(9): 656 18 Eschenhagen PN et al.: Proliferative activity of antigen-specific CD154+ T cells against bacterial and fungal respiratory pathogens in cystic fibrosis decreases after initiation of highly effective CFTR modulator therapy. Front Pharmacol 2023; 14: 1180826 19 Jones JT et al.: The cystic fibrosis treatment Trikafta affects the growth, viability, and cell wall of Aspergillus fumigatus biofilms. mBio 2023; 14(5): e0151623
Das könnte Sie auch interessieren:
Allergologische Diagnostik von Überempfindlichkeitsreaktionen auf Arzneimittel
Ungefähr 10% der Allgemeinbevölkerung berichten von unerwünschten Arzneimittelreaktionen, welche sich allerdings nur in weniger als 10% der Fälle diagnostisch verifizieren lassen. ...