Vaskuläre Effekte von GLP-1 und anderen Inkretinmimetika
Autorinnen: Mag. Andrijana Kirsch, PhD
Giada Benedetti
Univ.-Prof. Dr. Elena Osto
Lehrstuhl für Physiologie und Pathophysiologie, Otto Loewi Forschungszentrum für Gefäßbiologie, Immunologie und Entzündung Medizinische Universität Graz
Korrespondenz: Univ.-Prof. Dr. Elena Osto
E-Mail: elena.osto@medunigraz.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
GLP-1-Rezeptor-Agonisten und andere Inkretinmimetika revolutionieren die Stoffwechselmedizin. Sie zeigen eindrucksvolle kardiovaskuläre Schutzwirkungen. Ihre Effekte reichen von verbesserter Endothelfunktion über antiinflammatorische und antioxidative Mechanismen bis hin zu einer signifikanten Reduktion kardiovaskulärer Ereignisse – auch bei Menschen mit Adipositas ohne Diabetes.
Keypoints
-
GLP-1-Rezeptor-Agonistensenken kardiovaskuläre Ereignisse unabhängig von Glykämiekontrolle und Gewichtsverlust.
-
Sie verbessern die Endothelfunktion, Mikrozirkulation und Plaquestabilität über NO-, antioxidative und antiinflammatorische Signalwege.
-
Duale Inkretinmimetika wie Tirzepatid eröffnen neue Perspektiven der Gefäßprotektion.
-
Die Inkretintherapie markiert den Übergang von der Stoffwechsel- zur umfassenden kardiometabolischen Prävention.
Vom Inkretin zur vaskulären Prävention
Inkretine wie „glucagon-like peptide-1“ (GLP-1) und „glucose-dependent insulinotropic peptide“ (GIP) sind enterale Hormone, die nach Nahrungsaufnahme die Glukosehomöostase regulieren. Ihre pharmakologische Nutzung begann mit der Entwicklung stabiler GLP-1-Rezeptor-Agonisten (GLP-1-RA), die heute als wöchentliche Injektionen (z.B. Semaglutid, Dulaglutid, Liraglutid) oder als orale Präparate (z.B. Orforglipron)1 verfügbar sind. Mit dual wirksamen Molekülen wie Tirzepatid (GLP-1/GIP-Rezeptor-Agonist) wurde das Spektrum erweitert. Diese Substanzen wirken nicht nur metabolisch, sondern auch direkt vaskulär – ein Paradigmenwechsel in der Behandlung von Adipositas und kardiometabolischen Erkrankungen.2
Endothel und Mikrozirkulation als Zielstruktur
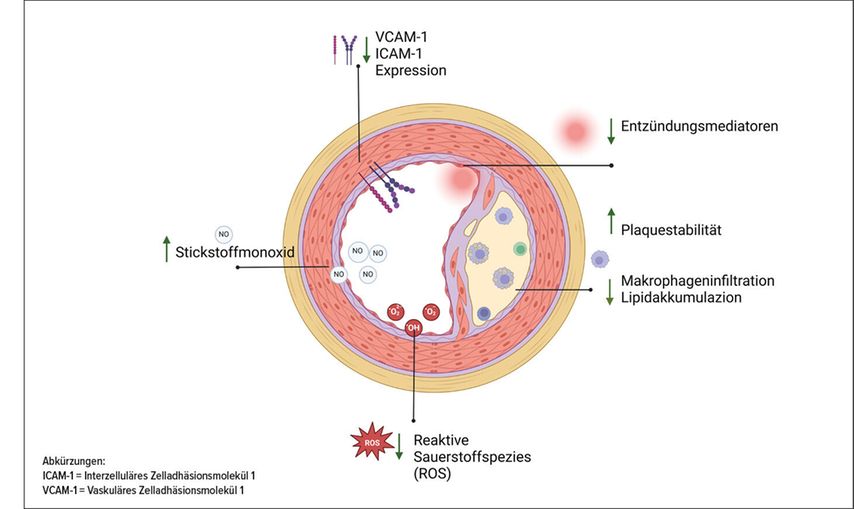
Das Gefäßendothel reguliert Vasomotorik, Gefäßpermeabilität und Entzündungsprozesse. Eine gestörte Endothelfunktion ist der früheste Marker der Atherosklerose, die zu Herz-Kreislauf-Erkrankungen und schwerwiegenden Komplikationen wie Herzinfarkten und Schlaganfällen führt. Zahlreiche Untersuchungen haben gezeigt, dass GLP-1-Rezeptor-Aktivierung direkt protektiv auf das Endothel wirkt(Abb 1).3,4 Unsere Arbeitsgruppe5 und andere2 haben gezeigt, dass GLP-1 die endotheliale Stickstoffmonoxid(NO)-Synthase stimuliert, was zu einer verstärkten NO-abhängigen Vasodilatation führte. Zusätzlich wurde die Belastung durch oxidativen Stress reduziert, indem Enzyme, die reaktive Sauerstoffspezies produzieren, wie die NADPH-Oxidase, durch GLP-1 gehemmt wurden. Dies schützt vor der Entkopplung der endothelialen NO-Synthase und der Bildung von schädlichem Peroxynitrit. GLP-1 und GLP-1-Rezeptor-Agonisten wie Exendin-4 und Liraglutid reduzieren die endotheliale Entzündung und verringern die Monozytenadhäsion an das Endothel, indem sie die Expression der Adhäsionsmoleküle VCAM-1 und ICAM-1 reduzieren. Studien zeigten eine Reduktion der Apoptose und eine erhöhte Regeneration, was die vaskuläre Reparatur fördert. Eine verbesserte Perfusion und Vasodilatation der Mikrozirkulation wurden wenige Wochen nach Beginn einer GLP-1-RA-Therapie beobachtet. Diese Mechanismen sind unabhängig vom Blutzuckerspiegel und erklären, warum Inkretinmimetika auch bei nichtdiabetischen Personen vaskulär sehr positive Effekte haben.
Abb. 1: Vasoprotektive Wirkung von GLP-1 und Inkretinmimetika. Die Abbildung wurde mit BioRender erstellt
Atheroprotektion
Inkretinmimetika zeigten positive Effekte bei Patient:innen mit Atherosklerose.6 Neben funktionellen Verbesserungen beeinflussen Inkretinmimetika die Plaquemorphologie. In experimentellen Modellen (Abb.1) senkte Liraglutid die Makrophageninfiltration und Lipidakkumulation in der Intima. Gleichzeitig erhöhte sich der Kollagengehalt – Zeichen erhöhter Plaquestabilität. Auch glatte Gefäßmuskelzellen reagieren auf GLP-1-Signale, indem deren Proliferation und Migration gehemmt werden. GLP-1-RA verbessern die HDL-Funktion und fördern den Cholesterinefflux aus Makrophagen.
GIP-Modulation und neue Kombinationen
Die Rolle von GIP ist komplex. Während physiologisches GIP lipogen wirkt, zeigen pharmakologische GIP-Agonisten in Kombination mit GLP-1-RA (Tirzepatid) synergistische Effekte. Der neuartige GLP-1-Agonist/GIP-Antagonist Maridebart Cafraglutide und der dreifache GLP-1/GIP/Glucagon-Agonist Retatrutide befinden sich in klinischen Studien. Diese zeigten, dass diese Substanzen zu einer signifikanten Gewichtsabnahme führen.7,8
Antiinflammatorische und immunmodulatorische Effekte
Kardiometabolische Erkrankungen sind durch chronische niedriggradige Entzündungszustände („metaflammation“) charakterisiert. GLP-1-RA senken IL-6, TNFα und MCP1 und hemmen die NF-κB-Aktivierung. Sie modulieren Makrophagen und fördern regulatorische T-Zellen. Diese immunmodulatorischen Effekte tragen zur Gefäßprotektion und Plaquestabilität bei. Tirzepatid und Maridebart Cafraglutide verstärken diese Wirkung über zusätzliche zentrale antiinflammatorische Signalwege.9
Evidenz für vaskuläre Effekte
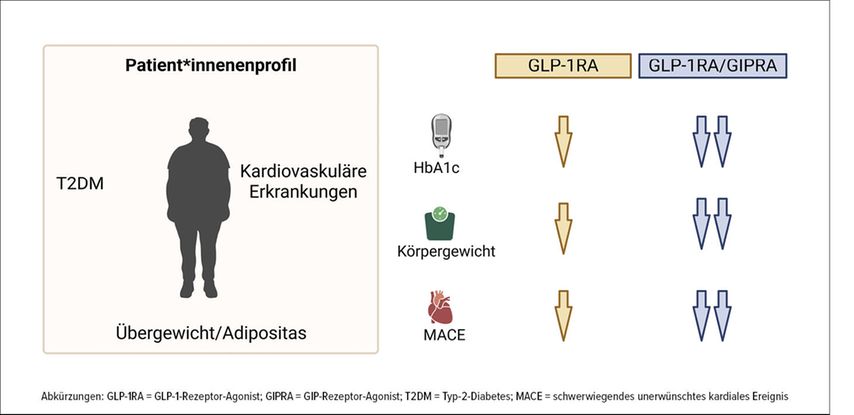
Die vaskulären Schutzwirkungen spiegeln sich in großen Endpunktstudien wider (Abb. 2). Die LEADER-Studie zeigte, dass Liraglutid bei Patient:innen mit Typ-2-Diabetes (T2DM) und hohem kardiovaskulärem Risiko den primären kombinierten Endpunkt (kardiovaskulärer Tod, nichttödlicher MI, nichttödlicher Schlaganfall) im Vergleich zu Placebo signifikant reduzierte.10 Ebenso war in einem Kollektiv von Patient:innen mit T2DM und hohem kardiovaskulärem Risiko die Rate an kardiovaskulären Todesfällen, nichttödlichen Myokardinfarkten oder nichttödlichen Schlaganfällen bei Patient:innen, die Semaglutid erhielten, signifikant niedriger als bei Patient:innen, die Placebo erhielten (SUSTAIN-6).11 In ähnlicher Weise zeigte die REWIND-Studie, dass Dulaglutid kardiovaskuläre Ereignisse bei Patienten mit T2DM verringerte.12 Darüber hinaus führte Semaglutid bei Patienten mit adipositasbedingter Herzinsuffizienz mit erhaltener Ejektionsfraktion und T2DM nach einem Jahr zu einer stärkeren Verringerung der herzinsuffizienzbedingten Symptome und körperlichen Einschränkungen sowie zu einem größeren Gewichtsverlust als Placebo (STEP-HFpEF).13 Die abgeschlossene, aber noch nicht veröffentlichte SURPASS-CVOT-Studie14 verglich Tirzepatid und Dulaglutid hinsichtlich schwerwiegender kardiovaskulärer Ereignisse bei Teilnehmer:innen mit T2DM und atherosklerotischer Herz-Kreislauf-Erkrankung. Die Ergebnisse wurden auf der Jahrestagung 2025 der Europäischen Vereinigung für die Erforschung von Diabetes (EASD) und auch während der Konferenz der American Heart Association 2025 vorgestellt. Sie zeigen, dass Tirzepatid den kardioprotektiven Nutzen von Dulaglutid bewahrt und gleichzeitig zusätzliche Vorteile bietet, darunter einen besseren Nierenschutz und ein geringeres Gesamtsterberisiko. Bei Patient:innen mit vorbestehenden Herz-Kreislauf-Erkrankungen und Übergewicht oder Adipositas, jedoch ohne Diabetes, war die wöchentliche Gabe von Semaglutid in einer Dosis von 2,4mg Placebo hinsichtlich der Verringerung der Inzidenz von Todesfällen aufgrund kardiovaskulärer Ursachen, nichttödlicher Myokardinfarkte oder nichttödlicher Schlaganfälle überlegen (SELECT-Studie).15 Weitere Analysen zeigten, dass die kardioprotektiven Wirkungen von Semaglutid unabhängig vom Baseline-Körpergewicht und dem Gewichtsverlust waren und nur einen geringen Zusammenhang mit dem Taillenumfang aufwiesen, was auf bestimmte Wirkmechanismen hindeutet, die über die Reduzierung der Adipositas hinausgehen.16
Abb. 2: Vaskuläre Schutzwirkungen von GLP-1-Rezeptor-Agonisten und GLP-1/GIP-Rezeptor-Agonisten. Die Abbildung wurde mit BioRender erstellt
Langzeit- und Sicherheitsaspekte
Gastrointestinale Nebenwirkungen sind häufig, schwerwiegende Ereignisse jedoch selten.17 Gallensteine treten etwas häufiger auf, vermutlich infolge des Gewichtsverlusts. Bisher gibt es keine überzeugenden Hinweise auf ein erhöhtes Risiko für Pankreatitis oder Tumoren. Angesichts einer potenziellen Langzeitanwendung über Jahrzehnte werden Sicherheitsaspekte zukünftig verstärkt im Fokus stehen.
Dank ihrer pleiotropen kardiovaskulären und renalen Effekte wurden GLP-1-RA ein wesentlicher Bestandteil der Therapieempfehlungen in den Guidelines zur Behandlung von Diabetes mellitus18 und Nierenerkrankungen19. Die European Society of Cardiology (ESC) arbeitet derzeit an Richtlinien über kardiovaskuläre Erkrankungen und Adipositas, deren Veröffentlichung für 2027 vorgesehen ist.20 In diesen Guidelines werden GLP-1-Rezeptor-Agonisten voraussichtlich eine zentrale Rolle bei der Behandlung von Adipositas und ihren kardiovaskulären Begleiterkrankungen einnehmen.
Literatur:
1 Wharton S et al.: Orforglipron, an oral small-molecule GLP-1 receptor agonist for obesity treatment. N Engl J Med 2025; 393(18): 1796-806 2 Ussher JR, Drucker DJ: Glucagon-like peptide 1 receptor agonists: cardiovascular benefits and mechanisms of action. Nat Rev Cardiol 2023; 20(7): 463-74 3 Battistoni A et al.: Glucagon-like peptide-1 receptor agonists and the endothelium: molecular and clinical insights into cardiovascular protection. Front Med (Lausanne). 2025; 12: 1669685 4 Hullon D et al.: The role of glucagon-like peptide-1 receptor (GLP-1R) agonists in enhancing endothelial function: a potential avenue for improving heart failure with preserved ejection fraction (HFpEF). Cardiovasc Diabetol 2025; 24(1): 70 5 Osto E et al.: Rapid and body weight-independent improvement of endothelial and high-density lipoprotein function after Roux-en-Y gastric bypass: role of glucagon-like peptide-1. Circulation 2015; 131(10): 871-81 6 Kirsch A et al.: Bile acids and incretins as modulators of obesity-associated atherosclerosis. Front Cardiovasc Med 2024; 11: 1510148 7 Jastreboff AM et al.: Triple-hormone-receptor agonist retatrutide for obesity - a phase 2 trial. N Engl J Med 2023; 389(6): 514-26 8 Jastreboff AM et al.: Once-monthly maridebart cafraglutide for the treatment of obesity - a phase 2 trial. N Engl J Med 2025; 393(9): 843-57 9 Muralikrishnan AS et al.: Immune and vascular function in cardiometabolic disorders: interplay with sex differences and impact on incretin therapy. Acta Physiol (Oxf). 2025; 241(9): e70091 10 Marso SP et al.: Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016; 375(4): 311-22 11 Marso SP et al.: Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016; 375(19): 1834-44 12 Gerstein HC et al.: Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet 2019; 394(10193): 121-30 13 Kosiborod MN et al.: Semaglutide in patients with obesity-related heart failure and type 2 diabetes. N Engl J Med 2024; 390(15): 1394-407 14 Nicholls SJ et al.: Comparison of tirzepatide and dulaglutide on major adverse cardiovascular events in participants with type 2 diabetes and atherosclerotic cardiovascular disease: SURPASS-CVOT design and baseline characteristics. Am Heart J 2024; 267: 1-11 15 Lincoff AM et al.: Semaglutide and cardiovascular outcomes in obesity without diabetes. N Engl J Med 2023; 389(24): 2221-32 16 Deanfield J et al.: Semaglutide and cardiovascular outcomes by baseline and changes in adiposity measurements: a prespecified analysis of the SELECT trial. Lancet 2025; 406(10516): 2257-68 17 Psaltis JP et al.: Incretin-based therapies for the management of cardiometabolic disease in the clinic: Past, present, and future. Med Res Rev 2025; 45(1): 29-65 18 Marx N et al.: 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J 2023; 44(39): 4043-140 19 Kidney disease: improving global outcomes CKDWG. KDIGO 2024 Clinical Practice Guideline for the evaluation and management of chronic kidney disease. Kidney Int 2024; 105(4S): S117-S314 20 European Society of Cardiology: Guidelines Publication Schedule. www.escardio.org/Guidelines/Clinical-Practice-Guidelines/ESC-Guidelines-Publication-Schedule#
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...