Trikuspidalklappe verstehen: von der Anatomie bis zur Intervention
Autoren:
Dr. Varius Dannenberg
Assoc. Prof. Dr. Georg Goliasch, MD, PhD
Ap. Prof. Priv.-Doz. Dr. Philipp Emanuel Bartko, PhD
Universitätsklinik für Innere Medizin II
Abteilung für Kardiologie
Medizinische Universität Wien
E-Mail:
Die Trikuspidalklappe ist in den letzten Jahren in den Fokus der medizinischen Forschung gerückt. Gründe dafür sind die hohe Morbidität und Mortalität von Patienten mit Trikuspidalinsuffizienz und die Entwicklung von kathetergestützten Verfahren zur Sanierung. Die komplexe Anatomie sowie die schwierige Bildgebung der Trikuspidalklappe sind dabei Hürden, die es zu überwinden gilt.
Keypoints
-
Die Trikuspidalklappe ist anatomisch sehr variabel.
-
Pathomechanismen bei Trikuspidalinsuffizienz sind am häufigsten sekundär bei Ringdilatation durch Ventrikel oder Atrium.
-
Der Schweregrad der Trikuspidalinsuffizienz umfasst ein breites Spektrum, weswegen 5 Grade derzeit etabliert sind.
-
Derzeit werden zahlreiche interventionelle Verfahren zur Sanierung der Trikuspidalklappe entwickelt.
Die häufigste Ursache der Trikuspidalinsuffizienz (TI) ist die sekundäre oder „funktionelle“ Insuffizienz, die eine bedeutende klinische Patientenpopulation mit wenigen Behandlungsmöglichkeiten definiert.1,2 Studien konnten zeigen, dass eine isolierte Dilatation des Trikuspidalrings/-anulus (TA), eine isolierte Papillarmuskelverschiebung oder die Kombination beider Mechanismen eine signifikante TI verursachen können.1 Jüngste dreidimensionale echokardiografische Studien haben die Rolle der Dilatation des rechten Vorhofs, die zu einer anulären Dilatation führt, sowie die Rolle der Dilatation des rechten Ventrikels (RV) und der Restriktion der Trikuspidalklappe (TK) bei Patienten mit TI bestätigt.1
In der folgenden Übersicht werden die komplexe Beziehung zwischen dem rechten Herzen und der TK und unser derzeitiges Verständnis von der funktionellen Anatomie beschrieben. Weiters wird die Graduierung der TI insbesondere im Zusammenhang mit neuen Konzepten im Kontext moderner Behandlungsstrategien beschrieben.
Funktionelle Anatomie der Trikuspidalklappe
Die Trikuspidalklappe besteht in der Regel aus drei ungleich großen Klappensegeln, die konventionell als anteriores, posteriores und septales Segel bezeichnet werden. Da das anteriore und das septale Segel in der Regel den größten Teil des TA abdecken, ist die anteroseptale Kommissur die längste.3 Meistens gibt es zwei Papillarmuskeln (anterior, posterior) sowie einen dritten variablen Papillarmuskel. Der anteriore Papillarmuskel ist der größte und versorgt die Chordae der vorderen und hinteren Segel.
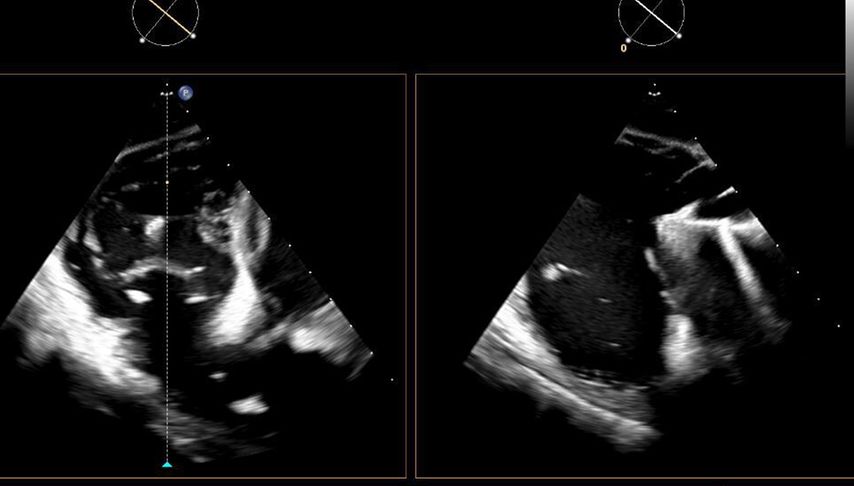
In Pathologiestudien wird seit Langem anerkannt, dass es bei gesunden Menschen eine unterschiedliche Anzahl von Klappensegeln gibt.4 Kürzlich wurde eine vereinfachte Nomenklatur vorgeschlagen, die für die präprozedurale Planung und Ausführung von katheterbasierten Klappenrekonstruktionen von Bedeutung sein könnte.4,5 Angesichts der Nähe der TK zur vorderen Brustwand und zum Zwerchfell kann die Morphologie entweder mit modifizierten Schnitten in der transthorakalen Echokardiografie (TTE), mit dem transgastrischen Kurzachsenschnitt in der transösophagealen Echokardiografie (TEE) oder mit einem 3D-Volumen-gerenderten Äquivalent aus beiden Modalitäten dargestellt werden (Abb. 1).
Abb. 1: Biplanare Darstellung eines „Edge-to-edge repair“-Devices aus dem transgastrischen Schallfenster
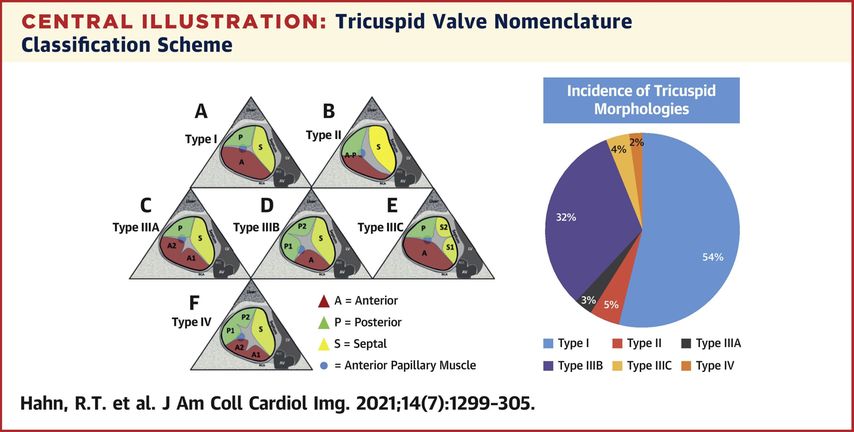
Vier Hauptklassen von Segelmorphologien sowie deren Häufigkeit werden unterschieden:
-
Typ I ist die klassische Morphologie mit drei Segeln (anteriores, septales und posteriores Segel) und in ca. 54% der Patienten, welche eine kathetergestützte Klappenrekonstruktion unterlaufen, zu beobachten.
-
Typ II ist die Morphologie mit zwei Segeln (anteriores und posteriores Segel verschmolzen) (Abb. 2).
-
Typ III ist die Konfiguration mit vier Segeln mit Unterkategorien, die auf der Lage des vierten Segels basieren, und
-
Typ IV hat mehr als vier Segel (Abb. 3).1
Abb. 3: Übersicht über die unterschiedlichen Trikuspidalklappenmorphologien (mit freundlicher Genehmigung aus Hahn et al.)4
Die Struktur und die Funktion der Herzklappen können zur Kategorisierung der TI verwendet werden. Drei strukturelle und funktionelle Merkmale helfen dabei, die wichtigsten Phenotypen zu klassifizieren:
-
pathologische Veränderungen der Segel, die zu Segeldefekten oder Fehlkoaptation führen – die primäre oder organische TI;
-
unzureichende Segelkoaptation aufgrund eines dilatierten TA – die atriale sekundäre TI;
-
unzureichende Segelkoaptation im Rahmen einer apikalen Verschiebung der Papillarmuskeln mit konsekutiver Restriktion der Klappensegel – die ventrikuläre sekundäre TI.
Zu den Ursachen der primären TI gehören: degenerative Erkrankungen (z.B. Prolaps), Trauma, Endokarditis, Karzinoid und rheumatische Erkrankungen. Die sekundäre atriale TI ist mit einer ausgeprägten Vorhof- und damit Ringdilatation, typischerweise weniger Restriktion der Trikuspidalsegel und häufig noch normaler rechtsventrikulärer Form und Funktion verbunden.1 TI, die in Zusammenhang mit transvalvulären Schrittmachersonden traditionell als primär eingestuft werden, sind eigentlich eine resultierende Komplikation, die sekundär nach dem Eingriff auftritt.
In der TTE sollte der TA-Durchmesser am Ende der Diastole in der apikalen Vierkammeransicht gemessen werden, und die TA-Dilatation ist definiert als ein TA-Durchmesser ≥40mm oder >21mm/m2.6 Die Abmessungen und die Form des TA ändern sich während des Herzzyklus erheblich, und die Messung des Anulus am Ende der Diastole bleibt umstritten,7 da die Insuffizienz meistens midsystolisch quantifiziert wird und die beiden Messungen somit in Bezug auf den Herzzyklus entkoppelt sind. Der TA ist kein stabiler Bindegewebsring, sondern vielmehr nur undeutlich und unvollständig gegenüber dem umliegenden Gewebe abgrenzbar, insbesondere in jenem Segment, das der freien RV-Wand entspricht. Diese Prädilektionsstelle erklärt auch die Dilatation in diesen Regionen, während septale Segmente weniger anfällig scheinen. Der TA ist oval, wird aber mit der Dilatation des RV kreisförmiger und planarer.
Der Trikuspidalring ist während des Herzzyklus hochdynamisch, und die Interaktion zwischen den Dimensionen, der Segelklappenkoaptation und dem Schweregrad der TI trägt zur Patientenprognose bei.
Klassifizierung der sekundären TI
Seit vielen Jahren wird die sekundäre TI als eine eigenständige Entität betrachtet, welche in erster Linie durch atriale, ventrikuläre sowie hämodynamische Alterationen auftritt.
Die unterschiedlichen zugrundeliegenden Mechanismen sowie die Ergebnisse nach einer TK-Sanierung haben dazu geführt, dass verschiedene Gruppen sekundärer TI, der unterschiedlichen Pathophysiologie und der charakteristischen Bildgebungsmerkmale definiert werden müssen. Diese Gruppen unterscheiden sich nicht nur in der Beweglichkeit des TK-Segels und der Art der Koaptation, sondern weisen auch ein unterschiedliches Ausmaß an strukturellen und funktionellen Alterationen auf.
Rezente Studien haben gezeigt, dass sich eine sekundäre TI nicht nur als Folge eines rechtsventrikulären Remodellings entwickelt, sondern auch durch eine Ringdilatation auf Basis einer atrialen Dilatation und Dysfunktion verursacht werden kann, ohne dass eine rechtsventrikuläre Anomalie, pulmonale Hypertension oder Linksherzerkrankung vorliegt.8 Diese Form der sekundären TI (früher als isolierte oder idiopathische TI bezeichnet) wird heute gemeinhin als atriale sekundäre TI bezeichnet und in neueren Leitlinien als eigenständige Entität mit einer grundlegend anderen Pathophysiologie im Vergleich zur traditionellen Form der sekundären TI aufgrund eines rechtsventrikulären Remodellings anerkannt.
Bei der atrialen sekundären TI handelt es sich um eine Ausschlussdiagnose, die durch das Fehlen jeglicher Anomalien der Herzklappen, einer LV-Dysfunktion, einer linksseitigen Klappenerkrankung, einer pulmonalen Hypertonie definiert ist.9 Morphologisch zeigt die sekundäre atriale TI eine ausgeprägtere anuläre Dilatation mit basaler ventrikulärer Dilatation.
Die neue Klassifizierung der sekundären TI, bei der die atriale von der ventrikulären Form der sekundären TI unterschieden wird, hat prognostische und therapeutische Auswirkungen. Bei der sekundären atrialen TI kommt es aufgrund des raschen Fortschreitens des Schweregrads häufig zu einer sekundären RV-Dilatation und/oder Dysfunktion. Die Rhythmuskontrolle kann dazu beitragen, die atriale sekundäre TI durch ein „reverse remodelling“ zu verringern.7
Bewertung des Schweregrads der TI im Kontext neuer Konzepte und Behandlungsstrategien
Unabhängig von der jeweiligen Bildgebungsmethode ist die Grundlage für die Beurteilung des Schweregrads der TI eine gründliche Untersuchung ihrer anatomischen und funktionellen Grundlagen. Als Teil des strukturierten Ansatzes zur Beurteilung des Schweregrads der TI wird als erster Schritt eine detaillierte morphologische und funktionelle Charakterisierung empfohlen, wie oben ausführlich beschrieben. In den folgenden Abschnitten werden die jüngsten Entwicklungen der TI-Bewertung und der Schweregradeinstufung mit einem Fokus auf echokardiografische Methodologie erläutert.
Die TI wird am häufigsten mittels transthorakaler Echokardiografie beurteilt.1,10 Diese Modalität ist allgemein verfügbar, kostengünstig, hat eine hohe zeitliche Auflösung und liefert bei der Mehrzahl der Patienten wichtige Hinweise auf die Ätiologie und die Mechanismen.
Bei Patienten mit signifikanter TI kann die TEE zusätzliche Aspekte zur Ätiologie und zum Mechanismus sowie zur Erfolgswahrscheinlichkeit der Behandlungsstrategie liefern. Die TI ist häufig dynamisch und ihr Schweregrad variiert je nach dem jeweiligen Kontext, der in die Bewertung einbezogen werden muss. Die Bewertung der TI basiert auf qualitativen, semiquantitativen und quantitativen Methoden.6,11
Die routinemäßige Messung mehrerer Aspekte wie Vena contracta, effektiver Regurgitationsöffnungsfläche und Regurgitationsvolumen, sowie deren kritische Bewertung werden empfohlen und erhöhen die Qualität der Befunde. Diese Messungen können den behandelnden Ärzten bei einer genaueren Risikostratifizierung helfen und ergänzende Informationen für Interventionen liefern.1,3 Das Bewusstsein für methodische Limitationen wie die geometrische Annahme einer kreisförmigen Öffnung beim Messen mithilfe der proximalen Konvergenzzone (PISA) ist für die Interpretation der Daten von entscheidender Bedeutung. Zwei Bereiche des TI-Schweregradspektrums sind in den letzten Jahren aufgrund der Entwicklung von risikoarmen Transkatheter-Reparaturstrategien von besonderem Interesse:
-
Die Übergangszone, in der die Volumenüberlastung der TI die individuelle Kompensationsreserve übersteigt und Herzversagen, kardiovaskuläre Morbidität und Mortalität ansteigen.1,12 Häufig wird das adaptive Potenzial des rechten Ventrikels überschritten und irreversible strukturelle Schäden können durch die Volumenüberlastung entstehen. In dieser Gruppe wird das Fortschreiten der TI häufig durch eine atriale und eine Ringdilatation beschleunigt, was für die Planung einer engmaschigen Nachsorge von klinischer Bedeutung ist.
-
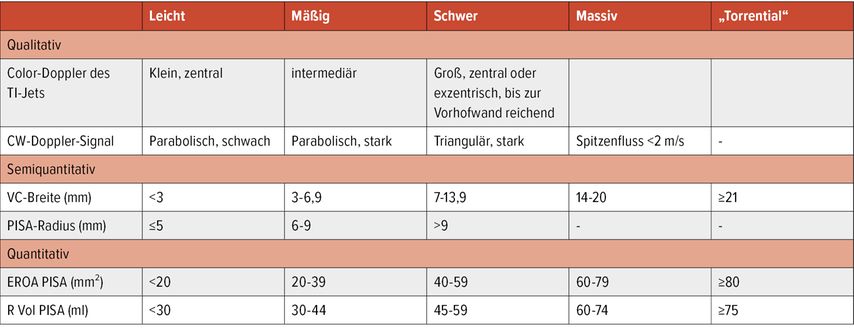
Das Ende des TI-Spektrums, das unter dem Oberbegriff „schwer“ zusammengefasst wird, scheint weitaus heterogener zu sein als bei der Mitralinsuffizienz mit effektiven Regurgitationsöffnungsflächen über 80mm2 (Abb. 4).
Die postinterventionelle Reduktion solch überbordender TI-Grade ist klinisch relevant, aber dennoch kann die postinterventionelle TI immer noch schwerwiegend sein. Zur genaueren Quantifizierung der TI für den Bereich „schwer“ wurde die Skala neulich um die Grade „massiv“ und „torrential“ erweitert.13, 14 Die Grenzwerte der derzeit etablierten Einstufung mit vorgeschlagener Erweiterung sind in Tabelle 1 aufgeführt.
Tab. 1: Derzeit etablierte Graduierung der Trikuspidalinsuffizienz mit 5 Schweregraden. TI = Trikuspidalinsuffizienz, CW „continuous wave“, VC = Vena contracta, PISA „proximal isovolumetric surface area“, EROA = „effective regurgitant orifice area“, R Vol = Regurgitationsvolumen
Behandlungsmöglichkeiten der sekundären TI
Die Behandlung der TI kann mit verschiedenen chirurgischen und interventionellen Ansätzen durchgeführt werden. Die Wahl zwischen den verschiedenen Optionen sollte sich nach dem zugrundeliegendenMechanismus der Insuffizienz sowie nach dem Zustand der Patienten und der Ätiologie der Erkrankung richten. Die klinischen Bedingungen beeinflussen die Wahl zwischen chirurgischen und interventionellen Lösungen. Die anatomisch-funktionelle Beurteilung der TK ist von entscheidender Bedeutung für die Wahl zwischen Ersatz und Reparatur. Bei Patienten, deren Anatomie für eine Reparatur geeignet ist, können die Feinheiten der Anatomie und Funktion der Klappenbestandteile die Reparaturstrategie und die verwendeten Techniken beeinflussen.
Multimodale Bildgebung wird eingesetzt, um die beste Behandlungsstrategie zu wählen. Im Zeitalter kathetergestützter Technologien ist die Auswahl des Devices, unterstützt durch die Analyse der anatomischen Merkmale, von entscheidender Bedeutung, um die besten Ergebnisse zu erzielen. Im Falle der funktionellen TI sind die Hauptkomponenten der Insuffizienz die anuläre Dilatation und die Restriktion der Segel. Je nach vorherrschender Funktionsstörung werden eine oder mehrere Korrekturmaßnahmen eingesetzt, um die Klappenfunktion wiederherzustellen.
Ein Klappenersatz wird bei Patienten bevorzugt, bei denen die Funktionsstörung und/oder die geometrische Verzerrung des Klappenapparats weiter fortgeschritten ist und eine Klappenreparatur als ineffizient oder nicht haltbar eingeschätzt wird. Bei Patienten, welche wegen eines linksseitigen Klappenvitiums oder einer Bypassoperation operiert werden, ist die Anuloplastie die gängigste Behandlungsmethode, kann jedoch insbesondere bei einer rechtsventrikulären Dysfunktion/Remodelling und ausgeprägten strukturellen Veränderungen eine Herausforderung sein. In diesem Fall werden zusätzliche Eingriffe an den Herzklappen (wie z.B. die Augmentation der Segel oder die Clover-Naht) eingesetzt, um die Ergebnisse zu verbessern. Die Bildgebung ist entscheidend in Zusammenhang mit interventionellen Verfahren, insbesondere im Falle einer geplanten Rekonstruktion.3
In den letzten zehn Jahren wurde eine Vielzahl von Devices eingeführt, die einen chirurgischen Eingriff über einen Katheter ermöglichen. Viele Verfahren befinden sich noch in der Erprobungsphase, während sich einige interventionelle Ansätze immer mehr durchsetzen. Die größte Erfahrung besteht mit der Transkatheter-„edge-to-edge“-Reparatur (TEER) unter Verwendung des MitraClip- oder des PASCAL-Systems. Die meisten Patienten können mit dem TEER-Ansatz behandelt werden, doch zeigen erste Daten, dass Patienten mit massiv dilatiertem Anulus und sehr großen Koaptationslücken keine optimalen Kandidaten sind.15
Es sind einige Anuloplastie-Devices erhältlich, die als eigenständiges Verfahren bei Patienten eingesetzt werden könnten, bei denen die Restriktion der Segel weniger ausgeprägt ist. Die wichtigsten Faktoren für den Erfolg des Verfahrens sind hier ebenso die Größe des Anulus und der Abstand des Anulus von der rechten Koronararterie.
Theoretisch könnten Anuloplastie und TEER in Kombination verwendet werden, ähnlich wie bei der chirurgischen Anuloplastie und der Clover-Naht. Bei Patienten mit fortgeschrittenen geometrischen Veränderungen der Klappenbestandteile und des rechten Ventrikels ist der Klappenersatz eine Option, die sich noch in der Anfangsphase befindet, da noch keine Devices zur kommerziellen Verwendung verfügbar sind.
Die Auswahl der Patienten basiert hauptsächlich auf der computertomografischen Untersuchung, um die Abmessungen des Rings, die Anatomie und Größe der rechten Herzkammer sowie die Lage der Hohlvenen zu beurteilen. Echokardiografie und Rechtsherzkatheteruntersuchung sind für die Patientenauswahl von grundlegender Bedeutung, um Patienten mit einer zu weit fortgeschrittenen Rechtsherzerkrankung auszuschließen und eine Risikostratifizierung vorzunehmen.
Literatur:
1 Bartko P et al.: Secondary valve regurgitation in patients with heart failure with preserved ejection fraction, heart failure with mid-range ejection fraction, and heart failure with reduced ejection fraction. Eur Heart J 2020; 41(29): 2799-810 2 Topilsky Y et al.: Burden of tricuspid regurgitation in patients diagnosed in the community setting. JACC Cardiovasc Imaging 2019; 12(3): 433-42 3 Dannenberg V et al.: Diagnostic assessment and procedural imaging for transcatheter edge-to-edge tricuspid valve repair: a step-by-step guide. Eur Heart J Cardiovasc Imaging 2021; 22(1): 8-10 4 Hahn RT et al.: Proposal for a standard echocardiographic tricuspid valve nomenclature. JACC Cardiovasc Imaging 2021; 14(7): 1299-305 5 Sugiura A et al.: Leaflet configuration and residual tricuspid regurgitation after transcatheter edge-to-edge tricuspid repair. JACC Cardiovasc Interv 2021; 14(20): 2260-70 6 Zoghbi WA et al.: Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the American Society of Echocardiography developed in Collaboration with the Society for Cardiovascular Magnetic Resonance. J Am Soc Echocardiogr 2017; 30(4): 303-71 7 Vahanian A et al.: 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2021; ehab395 8 Guta A et al.: The pathophysiological link between right atrial remodeling and functional tricuspid regurgitation in patients with atrial fibrillation: a three-dimensional echocardiography study. J Am Soc Echocardiogr 2021; 34(6): 585-94.e1 9 Otto CM et al.: 2020 ACC/AHA guideline for the management of patients with valvular heart disease: executive summary: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 2021; 143(5): e35-e71 10 Hahn RT et al.: Imaging assessment of tricuspid regurgitation severity. JACC Cardiovasc Imaging 2019; 12(3): 469-90 11 Lancellotti P et al.: European Association of Echocardiography recommendations for the assessment of valvular regurgitation. Part 2: mitral and tricuspid regurgitation (native valve disease). Eur J Echocardiogr 2010; 11(4): 307-32 12 Bartko P et al.: Natural history of functional tricuspid regurgitation: implications of quantitative Doppler assessment. JACC Cardiovasc Imaging 2019; 12(3): 389-97 13 Go YY et al.: The conundrum of tricuspid regurgitation grading. Front Cardiovasc Med 2018; 5: 164 14 Hahn RT et al.: The need for a new tricuspid regurgitation grading scheme. Eur Heart J Cardiovasc Imaging 2017; 18(12): 1342-3 15 Hausleiter J et al.: Patient selection, echocardiographic screening and treatment strategies for interventional tricuspid repair using the edge-to-edge repair technique. EuroIntervention 2018; 14(6): 645-53
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...