Neue Therapiestrategien zur Behandlung des Vorhofflimmerns: der Trend hin zur Rhythmuskontrolle und Ablation
Autor*innen:
Dr. med. Annina Stauber
Oberärztin Rhythmologie
Dr. med. Andreas Müller
Leitender Arzt und Leiter Elektrophysiologie
Stadtspital Triemli
Birmensdorferstrasse 497
8063 Zürich
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Vorhofflimmern (VHF) ist eine progrediente Erkrankung mit hoher Inzidenz. Innerhalb des letzten Jahres hat sich die Therapiestrategie einem Wandel unterzogen. Der seit gut einem Jahrzehnt geltende Therapiegrundsatz, dass sich Rhythmus- und Frequenzkontrolle nur hinsichtlich der Symptomkontrolle unterscheiden, muss aufgrund verschiedener neuer Studien (z.B. EAST-AF-NET4, CASTLE-AF, CABANA) revidiert werden.1–3 Grund für diesen Wandel dürften u.a. die höhere Effektivität und Sicherheit der heute zur Verfügung stehenden Methoden zur Rhythmuskontrolle, insbesondere der Katheterablation, sein. Durch diese invasive Behandlung können die VHF-Last und damit die negativen Auswirkungen des VHF auf die Hämodynamik und das thromboembolische Risiko signifikant reduziert werden.1
Keypoints
-
Vorhofflimmern ist die häufigste anhaltende Rhythmusstörung.
-
Die Inzidenz ist im Alter zunehmend.
-
Vorhofflimmern ist assoziiert mit einer erhöhten Mortalität und erheblichen Morbidität.
-
Neuere klinische Studien konnten zeigen, dass die Rhythmuskontrolle zur Wiederherstellung des Sinusrhythmus nicht nur die Lebensqualität, sondern auch klinische Endpunkte wie die Herzinsuffizienz, das Hirnschlagrisiko und in gewissen Fällen auch die Mortalität günstig beeinflussen kann.1,2
Die Prävalenz von Vorhofflimmern (VHF) nimmt mit dem Alter zu und liegt bei den 80-Jährigen bei 10%.4 Die häufigste Rhythmusstörung geht mit einer Reihe von Folgeproblemen einher. Als Erstes zu nennen ist die Mortalität, die bei Vorhofflimmern erhöht ist.5 Weiterhin hat das Vorhofflimmern auch ungünstige Effekte auf das Hirnschlagrisiko und thromboembolische Ereignisse, die Herzinsuffizienz und die Hospitalisationsrate.5
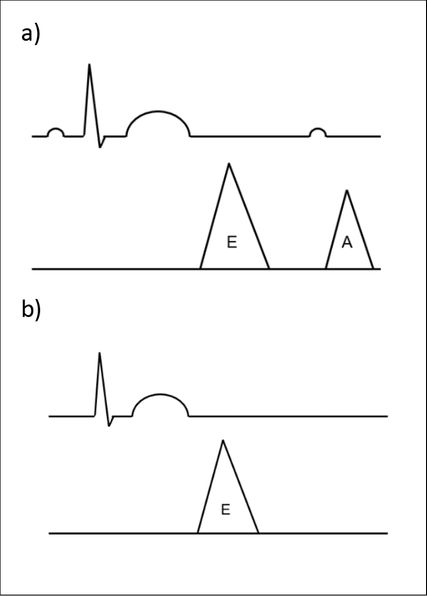
Abb. 1: a) Sinusrhythmus: Die E-Welle entspricht dem Sog bei Ventrikelrelaxation (80% des Volumenflusses). Die elektrische Aktivierung des Vorhofs (P-Welle) löst eine Vorhofkontraktion aus, welche echokardiografisch als A-Welle darstellbar ist (20% des Volumenflusses). b) Vorhofflimmern: Es fehlt eine organisierte elektrische Aktivierung und somit auch eine mechanische Kontraktion des Vorhofs
Neben den assoziierten somatischen Erkrankungen hat das Vorhofflimmern einen negativen Einfluss auf die Lebensqualität, wobei eine Korrelation mit der VHF-Last besteht und das psychische Wohlbefinden der Patienten reduziert sein kann.5,6
Die Pathophysiologie des Vorhofflimmerns gestaltet sich wie folgt: Das Vorhofflimmern hat einen ungünstigen Effekt auf die Pumpfunktion des Herzens. Im Sinusrhythmus wird die diastolische Füllung des linken Ventrikels durch zwei Mechanismen herbeigeführt. Einerseits durch die Ventrikelrelaxation mit Sogwirkung im Vorhof, die 80% der diastolischen Füllung ausmacht. Dieser Fluss kann echokardiografisch dargestellt werden und entspricht der E-Welle im Mitraleinstrom-Muster. Andererseits trägt die Vorhofkontraktion, auch «atrial kick» genannt, die restlichen 20% des Volumenflusses bei. Dieser kann auch echokardiografisch dargestellt werden und entspricht der A-Welle, welche am Ende der ventrikulären Diastole liegt. Beim Vorhofflimmern fällt aufgrund der fehlenden mechanischen Funktion dieser «atrial kick» weg (Abb. 1).
Hämodynamik des Vorhofflimmerns
Während der Wegfall des «atrial kick» bei einigen Menschen gut kompensiert werden kann, leiden andere unter Dyspnoe, Müdigkeit und reduzierter Leistungsfähigkeit. Ausserdem kommen die Irregularität des Pulses, die unphysiologische Frequenzadaptation und bei brady- oder tachykardem Vorhofflimmern die unphysiologische Frequenz hinzu, welche die Symptome ebenfalls verschlechtern können.
Beim VHF sind alle drei Komponenten der Virchow’schen Trias betroffen. Der Blutfluss ist vor allem im Vorhofsohr reduziert, die Endothelfunktion ist im mechanisch ineffektiven Vorhof gestört und die prothrombotische Aktivität des Blutes ist erhöht.7
Thromboembolierisiko
Das Hirnschlagrisiko kann mit dem CHA2DS2-VASc-Score abgeschätzt werden. In diesen Score fliessen die Herzinsuffizienz, eine arterielle Hypertonie, das Alter (>65 bzw. >75 Jahre), ein Diabetes mellitus, ein früherer Hirnschlag, vaskuläre Probleme sowie beim Vorliegen anderer Risikofaktoren auch das weibliche Geschlecht mit ein. Als Faustregel gilt hier: Bei einem Score von 0–4 Punkten erhöht sich das Risiko für einen Hirnschlag innerhalb eines Jahres pro Punkt um etwa 1%. Ab 5 Punkten ist das Risiko stärker erhöht (6,7–15,2% pro Jahr).5
Basierend auf der Beobachtung, dass Patienten mit paroxysmalem Vorhofflimmern das gleiche thromboembolische Risiko haben wie Patienten mit persistierendem oder permanentem Vorhofflimmern, wird die Indikation für eine Antikoagulation unabhängig von der VHF-Last gestellt.5 Es gibt jedoch Daten, die auf die Wichtigkeit der VHF-Last für das Hirnschlagrisiko hinweisen. Grosse NOAC-Studien haben in Post-hoc-Analysen ein niedrigeres Hirnschlagrisiko bei paroxysmalem Vorhofflimmern im Vergleich zu persistierendem Vorhofflimmern gezeigt.8–10
In der ASSERT-Studie zeigte sich, dass das Thromboembolierisiko erst ab einer VHF-Dauer >24h erhöht war.11
Rhythmuskontrolle und die Bedeutung der VHF-Last
Mit dem technischen Fortschritt verbessert sich die Datenerhebung in den Studien. Früher wurde Vorhofflimmern anhand der Symptome und mittels 12-Kanal- oder Langzeit-EKG (Dauer >30s) dokumentiert. Dies ist eine Erklärung dafür, dass bis vor Kurzem eine grobe Einteilung in paroxysmales, persistierendes und permanentes Vorhofflimmern gemacht wurde. Mithilfe von implantierten Loop-Recordern (ILR) sowie Schrittmachern und ICD mit einer Vorhofselektrode ist heute eine viel genauere Bestimmung der VHF-Last möglich.
Aus der LOOP-Studie ist bekannt, dass bei Patienten ohne anamnestisch bekanntes Vorhofflimmern etwa 80% der VHF-Episoden asymptomatisch verlaufen.12 Nach VHF-Ablation wird ein ähnlicher Effekt bezüglich der Symptomatik beschrieben. Mittels ILR wurde in neueren Studien die Rezidivhäufigkeit nach VHF-Ablation neu dokumentiert. In der CIRCA-DOSE-Studie waren 1 Jahr nach Ablation eines paroxysmalen Vorhofflimmerns etwas mehr als 50% der Patienten rezidivfrei (ILR), subjektiv beschwerdefrei jedoch fast 80%.13 Ähnliche Werte wurden durch die EARLY-AF-Studie nachgewiesen, in welche Patienten mit persistierendem Vorhofflimmern eingeschlossen wurden. Hier waren nach Ablation die mit ILR monitorisierten Patienten zu 57% rezidivfrei, klinisch dagegen 89%.14 Bei einer Behandlung mit Antiarrhythmika betrug die elektrische Rezidivfreiheit 32%, die subjektive 73%.14 EARLY-AF und STOP-AF First, zwei randomisierte multizentrische Studien, konnten die Überlegenheit der Katheterablation im Vergleich zur medikamentösen Rhythmuskontrolle bei Patienten mit paroxysmalem und persistierendem Vorhofflimmern zeigen.14,15
Eine besondere Aufmerksamkeit gilt der VHF-Last. Durch die Katheterablation eines paroxysmalen Vorhofflimmerns kann eine Reduktion der mithilfe von ILR gemessenen Last um 98–100% erreicht werden.13,16
Bei einem Patienten, der beispielsweise 24h/Woche (=100h/Monat) ein Vorhofflimmern aufweist, tritt dieses nach der Ablation nur noch während 15–30min/Woche (=0–2h/Monat) auf. Da die Lebensqualität von der VHF-Last abhängig ist,5 verbessert sich die Lebensqualität nach Ablation.17 Ebenso kann diese Reduktion die unterschiedliche Häufigkeit von nachgewiesenem und symptomatischem Rezidiv erklären, da sehr kurze und nächtliche Episoden häufig unbemerkt bleiben.
Eine neue wegweisende Studie ist die randomisierte multizentrische EAST-AFNET4-Studie. Bei Patienten mit neu diagnostiziertem Vorhofflimmern (innerhalb eines Jahres, mediane Zeit von Diagnose bis Einschluss in Studie 36 Tage) wurden für die Rhythmuskontrollgruppe signifikant bessere Outcomes nachgewiesen. Die Rhythmuskontrolle wurde mittels Katheterablation oder mit Antiarrhythmika durchgeführt. Es zeigte sich ein signifikant niedrigeres Risiko für kardiovaskulären Tod, Hirnschlag oder Hospitalisation wegen Herzinsuffizienz oder akuten Koronarsyndroms über ein Follow-up von fünf Jahren. Dies war konsistent auch in Subgruppen, inklusive asymptomatischer Patienten und solcher mit Adipositas oder Herzinsuffizienz, der Fall.
Neben der Wirksamkeit ist auch das Risiko der jeweiligen Therapie zu berücksichtigen. Auch hier zeigt sich, dass die VHF-Ablation vorteilhafter ist gegenüber den Antiarrhythmika. Im Hinblick auf schwere unerwünschte Ereignisse war die Rate mit 3,2% nach Ablation geringer als bei der medikamentösen Rhythmuskontrolle mit einer Rate von 4,0%.14 Während bei der medikamentösen Rhythmuskontrolle auch andere Organe in Mitleidenschaft gezogen werden können, wie zum Beispiel Schilddrüse, Leber, Lunge, Augen und Haut bei Amiodaron, sind bei der interventionellen Rhythmuskontrolle primär vaskuläre Zugangsprobleme, Perikardtamponade und Schlaganfall als Risiken zu nennen.
Die ersten Resultate des ATTEST-Trials und die EAST-AFNET4-Studie ergeben Hinweise, dass eine frühe Rhythmuskontrolle das Fortschreiten der Erkrankung verlangsamen kann.1,18
Fazit
Zusammenfassend ist Vorhofflimmern zwar eine Alterserscheinung mit weitreichenden Konsequenzen für die Gesundheit der betroffenen Patienten. Wenn man aber früh den Sinusrhythmus wiederherstellt und stabilisiert, wozu die Katheterablation heute die Methode der Wahl ist, kann man die negativen Folgen des Vorhofflimmerns auf die Morbiditäten und wahrscheinlich auch auf die Mortalität reduzieren.1–3,14–15 Es ist darum sinnvoll, Patienten bei der ersten Episode von Vorhofflimmern für eine Rhythmuskontrolle mittels Katheterablation zu evaluieren.
Literatur:
1 Kirchhof P et al.: Early rhythm-control therapy in patients with atrial fibrillation. N Engl J Med 2020; 383: 1305-16 2 Marrouche NF et al.; CASTLE-AF Investigators: Catheter ablation for atrial fibrillation with heart failure. N Engl J Med 2018; 378: 417-27 3 Packer DL et al.; CABANA Investigators: Catheter ablation versus antiarrhythmic drug therapy for atrial fibrillation (CABANA) trial: study rationale and design. Am Heart J 2018; 199: 192-9 4 Go AS et al.: Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk factors In Atrial fibrillation (ATRIA) study. JAMA 2001; 285: 2370-5 5 Hindricks G et al.; ESC Scientific Document Group: 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS): the Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2020; 42: 373-498 6 Jansson V et al.: Atrial fibrillation burden, episode duration and frequency in relation to quality of life in patients with implantable cardiac monitor. Int J Cardiol Heart Vasc 2021; 34: 100791 7 Watson T et al.: Mechanisms of thrombogenesis in atrial fibrillation: Virchow’s triad revisited. Lancet 2009; 373: 155-66 8 Link MS et al.; ENGAGE AF-TIMI 48 Investigators: Stroke and mortality risk in patients with various patterns of atrial fibrillation: results from the ENGAGE AF-TIMI 48 Trial (Effective Anticoagulation With Factor Xa Next Generation in Atrial Fibrillation-Thrombolysis in Myocardial Infarction 48).Circ Arrhythm Electrophysiol 2017; 10: e004267 9 Al-Khatib SM et al.: Outcomes of apixaban vs. warfarin by type and duration of atrial fibrillation: results from the ARISTOTLE trial. Eur Heart J 2013; 34: 2464-71 10 Steinberg BA et al.; ROCKET AF Steering Committee and Investigators: Use and outcomes of antiarrhythmic therapy in patients with atrial fibrillation receiving oral anticoagulation: results from the ROCKET AF trial. Heart Rhythm 2014; 11: 925-32 11 Hohnloser SH et al.; ASSERT Investigators and Committees: A Symptomatic atrial fibrillation and Stroke Evaluation in pacemaker patients and the atrial fibrillation Reduction atrial pacing Trial (ASSERT). Am Heart J 2006; 152: 442-7 12 Svendsen JH et al.: Implantable loop recorder detection of atrial fibrillation to prevent stroke (the LOOP Study): a randomised controlled trial. Lancet 2021; 398: 1507-16. Erratum in: Lancet 2021; 398: 1486 13 Andrade JG et al.; CIRCA-DOSE Study Investigators: Cryoballoon or radiofrequency ablation for atrial fibrillation assessed by continuous monitoring: a randomized clinical trial. Circulation 2019; 140: 1779-88 14 Andrade JG et al.; EARLY-AF Study Investigators: A randomized clinical trial of early invasive intervention for atrial fibrillation (EARLY-AF) - methods and rationale. Am Heart J 2018; 206: 94-104 15 Wazni OM et al.; STOP AF First Trial Investigators: Cryoballoon ablation as initial therapy for atrial fibrillation. N Engl J Med 2021; 384: 316-24 16 Duytschaever M et al.: Long-term impact of catheter ablation on arrhythmia burden in low-risk patients with paroxysmal atrial fibrillation: the CLOSE to CURE study. Heart Rhythm 2020; 17: 535-43 17 Terricabras M et al.; Substrate and Trigger Ablation for Reduction of Atrial Fibrillation Trial–Part II (STAR AF II) Investigators: Association between quality of life and procedural outcome after catheter ablation for atrial fibrillation: a secondary analysis of a randomized clinical trial. JAMA Netw Open 2020; 3: e2025473 18 Kuck KH et al.: Catheter ablation or medical therapy to delay progression of atrial fibrillation: the randomized controlled atrial fibrillation progression trial (ATTEST). Europace 2021; 23: 362-9
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...