Herz-Hirn-Achse: Neuromarker und Kognition bei Herzinsuffizienz
Autorin:
Dr. Suriya Prausmüller
Abteilung für Kardiologie Medizinische Universität Wien
Die Herz-Hirn-Achse rückt zunehmend in den Fokus der Herzinsuffizienzforschung. Kognitive Einschränkungen beeinflussen Therapieerfolg und Prognose, bleiben jedoch vielfach unerkannt. Ultrasensitive Blutmarker könnten künftig die diagnostischen Möglichkeiten zur frühzeitigen Erfassung neurodegenerativer Prozesse erweitern.
Keypoints
-
Kognitive Einschränkungen treten bei bis zu 40% der Patient:innen mit Herzinsuffizienz auf und gehen mit erhöhter Mortalität, einer höheren Hospitalisationsrate und eingeschränkter Therapieadhärenz einher.
-
Ultrasensitive Blutmarker wie NfL, GFAP und Tau korrelieren mit dem Schweregrad der Herzinsuffizienz sowie spezifischen neurokognitiven Defiziten.
-
Digitale Testsysteme können die Erfassung subtiler Funktionsbeeinträchtigungen unterstützen, die durch herkömmliche Screeningtests möglicherweise nicht adäquat erfasst werden.
-
Die Integration von Neuromarkern könnte zukünftig eine frühzeitige Identifikation vulnerabler Patient:innen ermöglichen und neuroprotektive Therapieansätze unterstützen.
Prävalenz und klinische Relevanz kognitiver Einschränkungen
Herzinsuffizienz geht häufig mit kognitiven Einschränkungen einher, die den Verlauf der Erkrankung und die Prognose maßgeblich beeinflussen. Mehr als 40% der Patient:innen weisen Symptome auf, die auf eine kognitive Dysfunktion hinweisen.1 Hierzu zählen insbesondere Defizite des Arbeitsgedächtnisses, der Aufmerksamkeit und der Verarbeitungsgeschwindigkeit; während akuter Dekompensationen kommt es häufig zu einer weiteren Verschlechterung der kognitiven Leistungsfähigkeit. Patient:innen, die zusätzlich zu einer Herzinsuffizienz kognitiv beeinträchtigt sind, zeigen zudem ein signifikant erhöhtes Risiko für unerwünschte klinische Ereignisse wie Stürze, ungeplante Hospitalisierungen, inadäquate Therapieadhärenz und erhöhte Mortalität.2–3 Dies führt nicht nur zu einer erheblichen Mehrbelastung des Gesundheitssystems, sondern geht auch mit einer deutlichen Minderung der Lebensqualität einher. Darüber hinaus erschwert eine kognitive Beeinträchtigung das Selbstmanagement und die korrekte Einnahme prognostisch relevanter Medikamente, was den Krankheitsverlauf ungünstig beeinflussen kann.
Pathophysiologische Mechanismen der Herz-Hirn-Achse
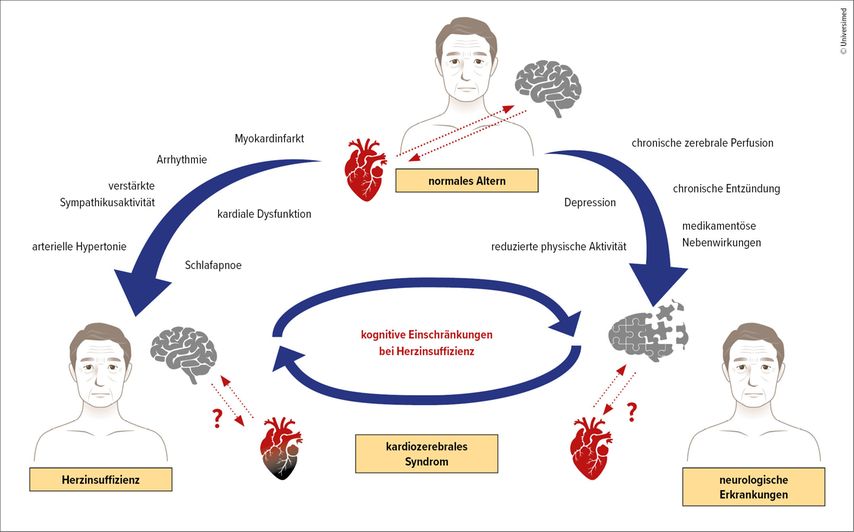
Zur Erklärung des Zusammenspiels zwischen Herzinsuffizienz und kognitiver Dysfunktion werden verschiedene pathophysiologische Mechanismen postuliert (Abb.1).4 Bildgebende Untersuchungen zeigen bei betroffenen Patient:innen strukturelle Veränderungen des zentralen Nervensystems, darunter kortikale Atrophie, hyperintense Läsionen der weißen Substanz, Verlust grauer Substanz sowie zerebrale (subklinische) Infarkte.5 Chronische systemische Inflammation, endotheliale Dysfunktion und neurohumorale Aktivierung – insbesondere über das Renin-Angiotensin-Aldosteron-System (RAAS) und adrenerge Signalwege – begünstigen eine Störung der zerebralen Durchblutung, oxidativen Stress und mikroangiopathische Veränderungen, die zu neuronalen Schädigungen führen können. Zudem zeigen klinische Studien Überschneidungen mit neurokognitiven Erkrankungen, einschließlich Morbus Alzheimer, was auf gemeinsame pathobiologische Mechanismen hinweist.6
Abb. 1: Übersicht über die wichtigsten Faktoren und ihre Wechselwirkungen, die zu kognitiven Beeinträchtigungen bei Herzinsuffizienz beitragen können
Von neuropsychologischen Testverfahren zu ultrasensitiven Blutmarkern
Die systematische Diagnostik kognitiver Beeinträchtigungen bei Patient:innen mit Herzinsuffizienz ist im klinischen Alltag bislang nur unzureichend verankert. Ausführliche neuropsychologische Untersuchungsverfahren liefern zwar valide Aussagen zur kognitiven Leistungsfähigkeit, sind jedoch zeitaufwendig, ressourcenintensiv und meist nicht flächendeckend einsetzbar. Standardisierte neurokognitive Screeningtests zeigen hingegen häufig eine geringe Sensitivität gegenüber subklinischen kognitiven Beeinträchtigungen, welche gerade im Frühstadium klinisch relevant sind. Digitale Testplattformen wie tabletgestützte Verfahren (z.B. CANTAB oder CogState) ermöglichen demgegenüber standardisierte Testbedingungen, geringe Übungseffekte und verlässliche Verlaufsbeobachtungen. Zudem lassen sich Einflüsse von Sprache und Bildungshintergrund minimieren, was den Einsatz im Rahmen routinemäßiger Visiten erleichtert.
Parallel hierzu gewinnt die Messung ultrasensitiver Blutmarker zunehmend an Relevanz. Die „Single molecule array“-Technologie ermöglicht die hochpräzise Quantifizierung neuronaler Strukturproteine wie Neurofilament-Leichtketten (NfL), gliales fibrilläres saures Protein (GFAP), Tau, Amyloid-β sowie Ubiquitin-Carboxy-Terminal-Hydrolase-L1 (UCHL1) im peripheren Blut. Diese Biomarker stehen in engem Zusammenhang mit pathophysiologischen zerebralen Prozessen, etwa mit neuronaler und axonaler Degeneration, glialer Aktivierung, neuroinflammatorischen Prozessen sowie Veränderungen des Proteinmetabolismus. Darüber hinaus sind sie mit strukturellen Veränderungen des Gehirns assoziiert, wie Beeinträchtigungen der zerebralen Perfusion, Hirnatrophie und weiteren degenerativen Umbauprozessen.7 In klinischen Studien zeigten erhöhte Konzentrationen dieser Neuromarker eine enge Assoziation mit einem höheren Schweregrad der Herzinsuffizienz sowie mit einer erhöhten Rate an Hospitalisierungen und einer höheren Gesamtmortalität bei Patient:innen mit Herzinsuffizienz.8 Die prognostische Aussagekraft von NfL war dabei vergleichbar mit etablierten Risikomarkern wie N-terminales Pro-B-Typ-natriuretisches Peptid (NT-proBNP) und blieb auch nach Berücksichtigung relevanter Einflussfaktoren bestehen. Diese Beobachtungen unterstreichen den Zusammenhang neurodegenerativer Prozesse mit der Progression der Herzinsuffizienz und weisen auf das Potenzial solcher Biomarker zur Risiko- und Verlaufsstratifizierung hin.
Neuromarker und kognitive Beeinträchtigungen bei HFrEF
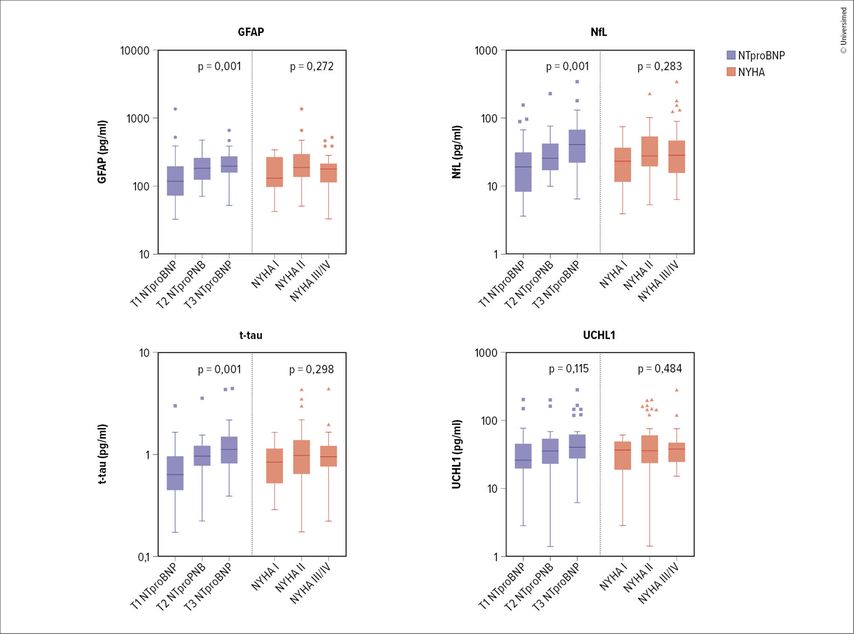
Im Rahmen einer aktuellen prospektiven Studie der Klinischen Abteilung für Kardiologie in Kooperation mit der Klinischen Abteilung für Neurologie der Medizinischen Universität Wien wurden insgesamt 121 Patient:innen mit Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF) rekrutiert. Patient:innen mit schwerer Herzinsuffizienz, charakterisiert durch hohe NT-proBNP-Werte, wiesen signifikant gesteigerte Konzentrationen von GFAP, NfL und Tau auf (Abb. 2).
Abb. 2: Zusammenhang zwischen Neuromarkern wie GFAP, NfL, Tau-Protein und UCHL1 mit dem Schweregrad der Herzinsuffizienz bei Patient:innen mit reduzierter Ejektionsfraktion
Die Spiegel einzelner Biomarker korrelierten dabei mit spezifischen kognitiven Leistungsbereichen: Höhere Konzentrationen von GFAP, NfL und UCHL1 waren mit einer Verlangsamung der Reaktionszeiten und Einschränkungen des räumlichen Arbeitsgedächtnisses assoziiert. Darüber hinaus zeigten erhöhte NfL- und Tau-Werte Zusammenhänge mit reduzierter Leistung unter Multitaskingbedingungen, während NfL und UCHL1 geringeres assoziatives Lernvermögen vorhersagten. Alle untersuchten Marker wiesen zudem signifikante Korrelationen mit dem räumlichen Arbeitsgedächtnis auf.
Insgesamt deuten diese Befunde auf domänenspezifische Zusammenhänge einzelner Biomarker mit unterschiedlichen kognitiven Funktionsbereichen hin und unterstreichen, dass eine fortgeschrittene Herzinsuffizienz mit ausgeprägteren kognitiven Defiziten einhergeht. Diese Ergebnisse deuten darauf hin, dass bei Patient:innen mit fortgeschrittener Herzinsuffizienz neben strukturellen Veränderungen auch funktionelle neurokognitive Veränderungen auftreten. Diese scheinen eng mit der Krankheitsprogression verknüpft zu sein und könnten auf frühe kognitive Beeinträchtigungen hinweisen. Da konventionelle Screeningverfahren derartig subtile Veränderungen häufig nicht zuverlässig erfassen, könnte die Kombination aus digitalem neurokognitivem Testen und ultrasensitiven Biomarkern eine Erweiterung bestehender diagnostischer Ansätze darstellen.
Klinische Bedeutung und Ausblick
Zusammengefasst verdeutlicht die aktuelle Evidenz, dass die Beziehung zwischen Herzinsuffizienz und kognitiver Dysfunktion komplex, multidimensional und klinisch bedeutsam ist. Die Verfügbarkeit sensitiver Biomarker bietet die Möglichkeit, neurokognitive Veränderungen möglicherweise frühzeitig zu erfassen, Risikopatient:innen zu identifizieren und potenziell präventive Strategien zu etablieren. Angesichts wachsender Prävalenzen, steigender Lebenserwartung und zunehmender Komplexität interdisziplinärer Versorgung gewinnt dieses Forschungsfeld weiter an Bedeutung. Ob therapeutische Interventionen neurodegenerative Biomarker reduzieren und kognitive Funktionen erhalten können, bedarf einer weiteren systematischen Untersuchung. Perspektivisch könnte die Kombination aus neuromolekularer Diagnostik und digitaler Kognitionsmessung zu einem früheren Erkennen vulnerabler Patient:innen beitragen und die Entwicklung zielgerichteter neuroprotektiver Strategien ermöglichen.
Literatur:
1 Vogels RLC et al.: Cognitive impairment in heart failure: A systematic review of the literature. Eur J Heart Fail 2007; 9(5): 440-9 2 Zuccalà G et al.: The effects of cognitive impairment on mortality among hospitalized patients with heart failure. Am J Med 2003; 115(2): 97-103 3 Huynh QL et al.: Mild cognitive impairment predicts death and readmission within 30 days of discharge for heart failure. Int J Cardiol 2016; 221: 212-7 4 Toledo C et al.: Neurocognitive disorders in heart failure: novel pathophysiological mechanisms underpinning memory loss and learning impairment. Mol Neurobiol 2019; 56(12): 8035-51 5 Li T et al.: Heart failure and cognitive impairment: a narrative review of neuroimaging mechanism from the perspective of brain MRI. Front Neurosci 2023; 17: 1148400 6 Van Nieuwkerk AC et al.: Cognitive impairment in patients with cardiac disease: implications for clinical practice. Stroke 2023; 54(8): 2181-91 7 Li D, Mielke MM: An update on blood-based markers of Alzheimer’s disease using the SiMoA platform. Neurol Ther 2019; 8(Suppl 2): 73-82 8 Wurm R et al.: Serum markers of neurodegeneration are strongly linked to heart failure severity and outcome. JACC Heart Fail 2024; 12(6): 1073-85
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...