Von Blutzellen zu Stammzellen: Neue Wege der Zellreprogrammierung
Autoren:
Prof. Dr. Frank Edenhofer
Director Institute of Molecular Biology & CMBI
President Austrian Society for Stem Cell Research
Marcel Tisch, MSc
Institute of Molecular Biology & CMBI
Genomics, Stem Cell Biology & Regenerative Medicine
Leopold-Franzens-Universität Innsbruck (LFUI)
E-Mail: frank.edenhofer@uibk.ac.at
Revolutionäre Fortschritte in der Stammzellforschung ermöglichen die künstliche Herstellung von menschlichen Stammzellen durch zelluläre Reprogrammierung. Ausgehend von patientenspezifischen Hautbiopsien oder Blutproben können somatische Zellen mittels vergleichsweise einfacher gentechnischer Verfahren in nahezu jeden beliebigen anderen Zelltyp umgewandelt werden. Die gewonnenen Stammzellen eröffnen eine neue, nahezu unerschöpfliche Quelle an patientenspezifischen Zellen zur In-vitro-Modellierung von Krankheiten, für Wirkstoffscreenings und für die Zellersatztherapie.
Meilenstein der Stammzellbiologie: Zelluläre Reprogrammierung
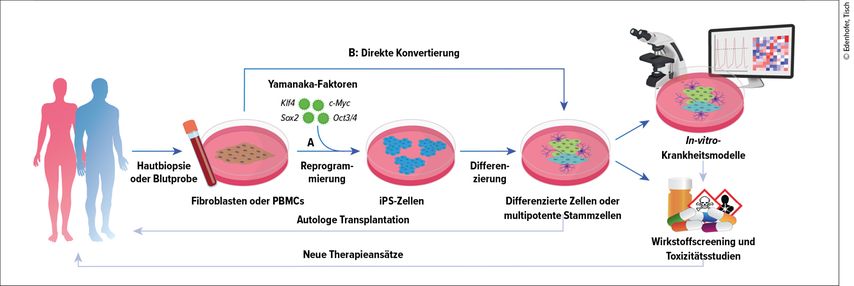
Im Jahr 2007 gelang dem Team des späteren Nobelpreisträgers Shin’ya Yamanaka erstmals die Reprogrammierung menschlicher Fibroblasten in sogenannte induzierte pluripotente Stammzellen (iPS-Zellen).1 Durch einen Cocktail von Transkriptionsfaktoren (OCT4, SOX2, KLF4, cMYC) können somatische Zellen künstlich in pluripotente Zellen reprogrammiert werden. Pluripotenz beschreibt das entwicklungsbiologische Potenzial von Zellen, in jeglichen anderen Zelltyp des ausgewachsenen Organismus ausreifen zu können. iPS-Zellen weisen ein unbegrenztes Selbsterneuerungs- und Differenzierungspotenzial auf und sind damit äquivalent zu embryonalen Stammzellen. Die Möglichkeit der Gewinnung pluripotenter Stammzellen aus adulten Fibroblasten und die anschließende Differenzierung ermöglichten somit erstmalig durch ein minimal invasives Vorgehen die Generierung beliebiger Zelltypen mit patientenspezifischem genetischem Hintergrund (Abb. 1A). Dies ist besonders bei Erkrankungen mit anderweitig unzugänglichen Zelltypen, wie z.B. bei den für neuropsychiatrische Erkrankungen relevanten Neuronen, ein revolutionärer Ansatz und somit von höchster Relevanz sowohl für die biomedizinische Grundlagenforschung als auch für den klinischen Einsatz in der autologen Zelltherapie.
Abb. 1: Generierung von patientenspezifischen Stammzellen aus dermalen Fibroblasten bzw. Blutproben mittels zellulärer Reprogrammierung. A: Durch Transduktion mit Yamanaka-Faktoren können dermale Fibroblasten bzw. PBMCs in iPS-Zellen reprogrammiert werden. B: Alternativ ermöglichen neu entwickelte Reprogrammierungsverfahren die direkte Konvertierung in multipotente Stammzellen oder differenzierte Zellen. Die gewonnenen differenzierten Zellen können genutzt werden, um die Auswirkungen der patientenspezifischen Mutation auf die Pathophysiologie histologisch, biochemisch und molekularbiologisch zu untersuchen – ggf. unter Anwendung genomweiter Methoden („multi-omics“ und „big data“). Derartig etablierte Krankheitsmodelle können zudem als Plattform für Wirkstoffscreenings und Toxizitätsstudien genutzt werden, was eine Grundlage zur Entwicklung neuer Therapieansätze darstellt. PBMCs = „peripheral blood mononuclear cells“
Die Stadien der In-vitro-Differenzierung rekapitulieren in vielen Fällen den Prozess der menschlichen Embryonalentwicklung und eignen sich daher nicht nur für die entwicklungsbiologische Grundlagenforschung, sondern auch zur molekularbiologischen Erforschung patientenspezifischer Mutationen und wie diese zur Bildung und Progression von Krankheitsbildern beitragen. Darüber hinaus bilden die vollständig differenzierten Zelltypen eine Plattform für Wirkstoffscreenings und erlauben somit die Entwicklung neuartiger Therapieansätze für die betroffenen Patienten. Im Falle von (neuro-)degenerativen Erkrankungen, wie z.B. der Parkinsonerkrankung, erhofft man sich zukünftig sogar, die gewonnenen differenzierten Zellen für autologe Transplantationen zum Ersatz der degenerierten dopaminergen Neurone zu verwenden.
Eine Abkürzung auf dem Weg der Reprogrammierung führt direkt zu Gehirnstammzellen
Neben der durch Yamanaka etablierten Reprogrammierung adulter menschlicher Zellen in iPS-Zellen ermöglichen weitere Fortschritte in der Stammzellforschung die direkte Konvertierung somatischer Zellen in andere gewünschte Zelltypen. In Abhängigkeit von den zur Konvertierung verwendeten Transkriptionsfaktoren lassen sich auch ausdifferenzierte Zelltypen oder multipotente Stammzellen direkt aus Patientenzellen gewinnen (Abb. 1 B). Multipotenz bedeutet, dass diese Zellen in bestimmte, aber nicht alle Zelltypen des Körpers differenziert werden können, wie beispielsweise hämatopoetische Stammzellen. Die Konvertierung von somatischen Zellen z.B. in multipotente induzierte neurale Stammzellen (iNS-Zellen) bietet ebenfalls die Möglichkeit zur anschließenden Generierung sämtlicher Zelltypen des menschlichen Gehirns.2,3 Dieser Ansatz verkürzt die Zeitspanne der Differenzierung im Vergleich zum herkömmlichen Ansatz mit iPS-Zellen deutlich. Darüber hinaus eröffnen direkte Konvertierungen in vollständig differenzierte Zelltypen (z.B. induzierte Neurone [iNs]) neue Möglichkeiten, beispielsweise bei der Erforschung von altersbedingten Erkrankungen (z.B. Alzheimerdemenz). Dem liegt die Tatsache zugrunde, dass während der Reprogrammierung in iPS-Zellen nahezu alle epigenetischen Modifikationen gelöscht werden und die Zellen somit ein verjüngtes molekulares Profil aufweisen. Durch direkte Konvertierung hingegen bleiben diese epigenetischen Modifikationen erhalten, was wiederum die Erforschung altersbedingter Komponenten des Krankheitsbildes ermöglicht.4
Reprogrammierung von Blutzellen zu iPS-Zellen in der Praxis
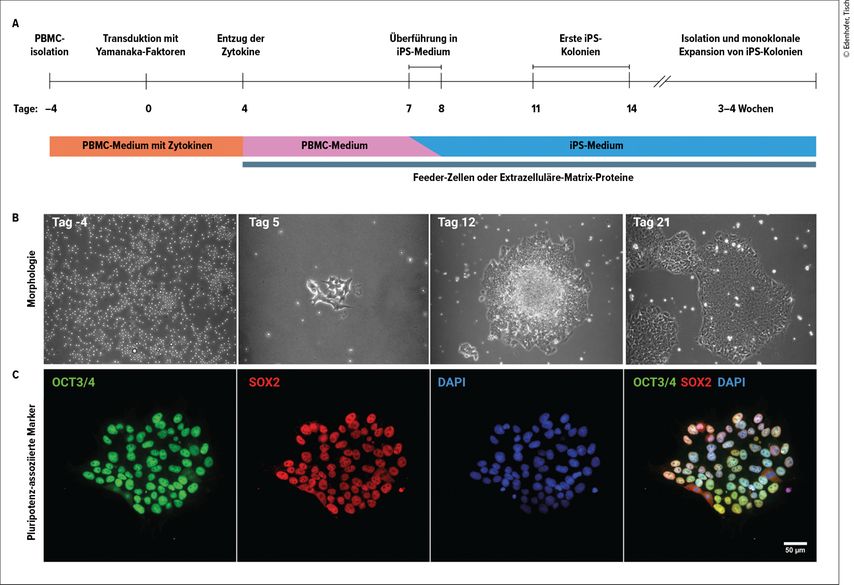
Während das initial etablierte Reprogrammierungsprotokoll auf der Isolation und Kultivierung dermaler Fibroblasten aus einer Hautbiopsie beruht, erlauben Fortschritte in der Stammzellforschung auch die Reprogrammierung und direkte Konvertierung von Blutzellen (Abb. 2A).5,6 Hierzu wird lediglich eine mit EDTA, Citrat oder Heparin versetzte Vollblutprobe der Patienten benötigt. Somit ist dieses Vorgehen deutlich weniger invasiv und daher leichter zugänglich als eine Stanzbiopsie, welche zur Gewinnung der dermalen Fibroblasten konventionell durchgeführt wird. Nach der Entnahme des Vollbluts erfolgt die Auftrennung des Bluts durch Dichtegradientenzentrifugation und die manuelle Isolierung der peripheren mononukleären Blutzellen (PBMCs, „peripheral blood mononuclear cells“). Diese werden anschließend für acht Tage in Kulturmedium mit einem Cocktail verschiedener Zytokine wie SCF, FLT-3 Ligand, IL-3 und IL-6 kultiviert. Für die Reprogrammierung werden die PBMCs mit nichtintegrierenden Viruspartikeln transduziert, welche die transiente Expression der Yamanaka-Faktoren bewirken. Dadurch wird das Gen-Netzwerk für zelluläre Pluripotenz aktiviert. Da der Übergang von PBMC zur iPS-Zelle mit der Adhäsion der sich ursprünglich in Suspension befindlichen Zellen einhergeht, müssen die transduzierten Zellen auf mit Feeder-Zellen oder mit einer künstlichen extrazellulären Protein-Matrix beschichtete Kulturschalen überführt werden. Weiterhin muss das Kulturmedium schrittweise gegen das spezielle Stammzellmedium ausgetauscht werden, welches die nötigen Wachstumsfaktoren beinhaltet, um die Selbsterneuerungskapazität zu unterstützen und die pluripotenten Stammzelleigenschaften zu erhalten. Anschließend müssen erfolgreich reprogrammierte Zellkolonien identifiziert, isoliert und weiter kultiviert werden, um eine Monoklonalität der etablierten Zelllinie zu erreichen (Abb. 2B). Abschließend erfolgen eine umfassende Charakterisierung und Validierung der gewonnenen iPS-Zellen hinsichtlich der Expression Pluripotenz-assoziierter Markergene sowie der Untersuchung des Differenzierungspotenzials durch gezielte Umwandlung der iPS-Zellen in Zelltypen aller drei Keimblätter (Abb. 2C). Die so gewonnenen iPS-Zellen können sofort weiterverwendet oder für mehrere Monate oder gar Jahre zur späteren Verwendung eingefroren werden.
Abb. 2: Protokoll zur Reprogrammierung von PBMCs. A: Zeitstrahldarstellung des Protokolls zur Reprogrammierung von PBMCs in iPS-Zellen. B: Morphologische Veränderung der Zellen im Laufe der Reprogrammierung. C: Charakterisierung der reprogrammierten Zellen hinsichtlich der Expression typischer Pluripotenz-assoziierter Marker (OCT3/4 und SOX2) durch Immunofluoreszenzanalyse mehrere Wochen nach der Transfektion
Durch Anwendung eines der für viele Zelltypen bereits etablierten Differenzierungsprotokolle können die Stammzellen anschließend in den gewünschten Zelltyp, wie z.B. Herzmuskelzellen, insulinproduzierende Betazellen oder (dopaminerge) Neurone, differenziert werden. Durch molekularbiologische Untersuchungen an mutierten Zellen von Patienten lassen sich Mechanismen der Pathophysiologie erforschen, die sich aus dem genetischen Hintergrund des jeweiligen Patienten ergeben. Wurde ein zellulärer Phänotyp identifiziert, können diese Krankheitsmodelle als Plattform für („high-throughput“) Wirkstoffscreenings verwendet werden, was die Identifizierung neuartiger Medikamente erlaubt. Zusammengefasst ermöglichen reprogrammierte Stammzellen so nicht nur die Grundlagenforschung an anderweitig unzugänglichem Probenmaterial zur Untersuchung von Krankheiten, sondern können auch bei der Entwicklung neuer Therapieansätze von entscheidender Bedeutung sein.
Literatur:
1 Takahashi K et al.: Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 2007; 131(5): 861-72 2 Thier M et al.: Direct conversion of fibroblasts into stably expandable neural stem cells. Cell Stem Cell 2012; 10(4): 473-9 3 Meyer S et al.: Derivation of adult human fibroblasts and their direct conversion into expandable neural progenitor cells. J Vis Exp 2015; 2015(101): 1-10 4 Mertens J et al.: Evaluating cell reprogramming, differentiation and conversion technologies in neuroscience. Nat Rev Neurosci 2016; 17(7): 424-37 5 Sharma A et al.: Human induced pluripotent stem cell production and expansion from blood using a non-integrating viral reprogramming vector. Curr Protoc Mol Biol 2018; 122(1): 1-20 6 Thier M et al.: Identification of embryonic neural plate border stem cells and their generation by direct reprogramming from adult human blood cells. Cell Stem Cell 2019; 24(1): 166-82
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
EHA 2018 NEWSROOM CH
… Unser Universimed-Team ist für Sie in Stockholm! Die European Hematology Association (EHA) macht dieses Jahr von 14. bis 17. Juni in Stockholm Halt und versammelt Experten aus Europa ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1