CAR-T-Zell-Therapie: vom Bridging bis zum Toxizitätsmanagement
Bericht:
Mag. Dr. Anita Schreiberhuber
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Seit der Einführung der CAR-T-Zell-Therapie wurden zunehmend Faktoren identifiziert, die Aussagen über die Wahrscheinlichkeit von Outcomes, aber auch über die Entwicklung von schweren Hämatotoxizitäten und Infektionen ermöglichen. Nach wie vor herrscht aber noch großer Optimierungsbedarf, wie beispielsweise bei der Lymphodepletion: Hier gilt es noch mittels eigens konzipierter Studien definierte Schemata zu untersuchen, um eine vereinheitliche Datenlage zu schaffen.
Bridging: Effekte auf die CAR-T-Zell-Therapie?
„In die Entscheidung, eine Bridging-Therapie durchzuführen, fließen diverse Faktoren wie z.B. Tumorcharakteristika, Tumorlast, Patient:innencharakteristika und vorangegangene Therapie(n) ein“, berichtete Dr. Anna Dodero, Fondazione IRCCS Istituto Nazionale dei Tumori, Mailand. Die Durchführung einer Bridging-Therapie während der Herstellung der CAR-T-Zellen, also in der Zeitspanne zwischen Leukapherese und Infusion, wird auch dazu genutzt, einer Krankheitsprogression (PD) entgegenzuwirken.1 Dass bei der Mehrheit der Patient:innen eine Bridging-Therapie zur Anwendung kommt, geht aus mehreren Real-World-Settings – wie der französischen Registerstudie DESCAR-T – hervor: Von 729 Patient:innen mit großzelligem B-Zell-Lymphom (LBCL) wurden 603 einer Bridging-Therapie zugeführt.1 Die Raten des Ansprechensauf die Bridging-Therapie im Sinne eines partiellen (PR) oder kompletten Ansprechens (CR) liegen zwischen 12 und 26%.1,2
Darüber hinaus konnte gezeigt werden, dass das Erzielen eines Ansprechens auf eine Bridging-Therapie in Korrelation mit der CAR-T-Zell-Konzentration und -Expansion steht3 und die Art des Ansprechens bzw. eine Non-Response (PR/CR vs. stabile Erkrankung [SD]/PD) prädiktiv für die Resultate nach der CAR-T-Zell-Infusion sind: Das progressionsfreie (PFS) und das Gesamtüberleben (OS) nach 12 Monaten lagen bei Erreichen einer PR/CR vs. SD/PD bei 50 vs. 21% bzw. bei 63 vs. 46%.4
Optimierung der Lymphodepletion-Regimes dringend nötig
Die Lymphodepletion ist der unmittelbar vor der CAR-T-Zell-Infusion etablierte Part im Rahmen des CAR-T-Zell-Therapie-Zyklus. „Sie ist essenziell, wird aber unterschätzt und könnte Effekte auf die T-Zell-Expansion ausüben. Es existiert keine systematische Evaluierung der Lymphodepletion. Die eingesetzten Therapieregimes beruhen auf empirischen Daten, sodass eine Optimierung dringend erforderlich ist“, erläuterte Univ.-Prof. Dr. Ulrich Jäger, Medizinische Universität Wien. „Von 1272 gescreenten CAR-T-Zell-Studien zu Axicabtagen Ciloleucel (Axi-Cel), Tisagenlecleucel (Tisa-Cel) und Lisocabtagen Maraleucel (Liso-Cel) sind nur aus 0,016% spezifische Daten zur Lymphodepletion verfügbar“, merkte Jäger weiters an.
Aus diesem Grund haben sich die Mitglieder des T2EVOLVE-Konsortiums, einer Vereinigung europäischer Expert:innen mit dem Hauptziel, die Entwicklung von CAR-T-Zell-Therapien zu beschleunigen und den Zugang dazu zu erleichtern, entschieden, eine Übersichtsarbeit zu diesem Thema zu verfassen. Darin wird nicht nur ein Überblick über die in klinischen Studien verwendeten Lymphodepletionsschemata und -dosen gegeben, sondern es wurden auch relevante Forschungsfragen definiert, die eine Hilfestellung bei der Konzeption von Lymphodepletionsprotokollen zur Entwicklung von optimierten Konditionierungsregimes bieten sollen.5
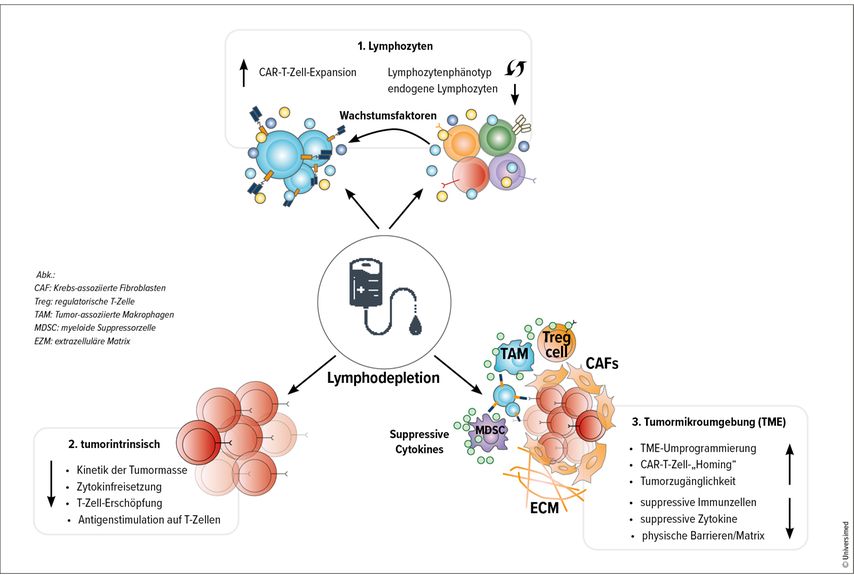
Zu den Zielen der Lymphodepletion zählen die Reduktion der endogenen Lymphozyten, um das Engraftment der CAR-T-Zellen vorzubereiten und ihre Langzeitaktivität zu unterstützen sowie die Reduktion der Tumorzellen und Reprogrammierung der Mikroumgebung, um optimales Engraftment, Homing und Langzeitüberleben der CAR-T-Zellen zu gewährleisten (Abb. 1).5
Abb. 1: Effekte der lymphodepletierenden Therapie auf den Empfänger/die Empfängerin: (1) Anzahl und Zusammensetzung der Wirts-Lymphozyten sowie der Zytokinproduktion. (2) Reduktion des Tumors und Modulation seines Verhaltens. (3) Reprogrammierung der Mikroumgebung des Empfängers/der Empfängerin für ein besseres „Homing“ der CAR-T-Zellen(modifiziert nach Lickefett B et al.)5
Hinsichtlich der Wirksamkeit gilt es als erwiesen, dass mit höheren Dosen zur Lymphodepletion bessere Effekte erzielt werden können. Eine der ersten Studien dazu, mit Cyclophosphamid/Fludarabin, einem der am häufigsten eingesetzten Lymphodepletions-Schemata,5 wurde 2019 von Hirayama et al. publiziert: Die Autor:innen haben nachgewiesen, dass eine höhere vs. eine weniger hohe Cyclophosphamid-Dosis (60mg/kg vs. <1500mg/m2 oder 30mg/kg) mit einer höheren Wahrscheinlichkeit eines günstigen Zytokinprofils und einer besseren Expansion der T-Zellen einhergeht.6
In einer weiteren Studie wurde der Frage nach der optimalen Dosis bzw. dem Threshold nachgegangen: Dabei wurden die Ergebnisse einer CAR-T-Zell-Therapie mit Tisa-Cel bei Kindern und Jugendlichen mit akuter lymphoblastischer B-Zell-Leukämie anhand der Fludarabin-Exposition (<14 vs. ≥14mg*h/l) im peripheren Blut untersucht und festgestellt, dass eine kumulative AUC („area under the curve“)T0−∞ ≥14 von Fludarabin mit einem längeren leukämiefreien Überleben und einer besseren T-Zell-Expansion assoziiert ist. Die klinischen Resultate dieser Patient:innen könnten durch Optimierung der Fludarabin-Exposition im Rahmen des Lymphodepletionsregimes noch weiter verbessert werden, was die Frage nach einer personalisierten Lymphodepletion aufwirft.7 Eine Möglichkeit dazu könnte ein populationsbasiertes Pharmakokinetikmodell sein, wie es Scordo et al. für eine Untersuchung an erwachsenen Lymphompatient:innen entwickelten: Die AUC von Fludarabin wurde anhand des Pharmakokinetikmodells berechnet, als optimale AUC wurde eine Fludarabin-Exposition von 18–20mg*h/l identifiziert: Sie ging mit dem längsten PFS und dem niedrigsten Rezidivrisiko einher.8
Bendamustin als Alternative zu Cyclophosphamid/Fludarabin?
Die vergleichbare Wirksamkeit, aber geringere Toxizität als Cyclophosphamid/Fludarabin sprechen für die Lymphodepletion mit Bendamustin.5 Dies konnte u.a. in einer Studie zum Vergleich dieser beiden Lymphodepletionsregimes bestätigt werden, in der 90 LBCL-Patient:innen vor der Gabe von Tisa-Cel mit Cyclophosphamid/Fludarabin und 40 mit Bendamustin behandelt worden sind. Bendamustin erwies sich als vergleichbar wirksam wie Cyclophosphamid/Fludarabin, führte zu höheren Neutrophilen- und Thrombozytenzahlen und einer rascheren Regeneration des Blutbilds. Hingegen ging Cyclophosphamid/Fludarabin mit einer höheren Rate an hämatologischen Nebenwirkungen und Zytokinfreisetzungssyndrom (CRS) sowie einer höheren Neurotoxizität einher.9
Dies konnte auch in einer Studie zu Bendamustin als Lymphodepletion vor einer CAR-T-Zell-Therapie mit Axi-Cel gezeigt werden, deren Ergebnisse untermauern, dass Benda eine sichere Alternative zu Cyclophosphamid/Fludarabin darstellt.10
Herausforderung der Resistenzmechanismen
Als mögliche Ursachen für ein CAR-T-Zell-Therapie-Versagen führte Ass. Prof. Dr. Marco Ruella, University of Pennsylvania, Präinfusionsprobleme, Wirtsfaktoren, CAR-T-Zell-Dysfunktion, tumorintrinsische Mechanismen, die Tumormikroumgebung sowie Toxizitäten an, wobei er spezifische Themen wie die Tumorbiologie näher beleuchtete.11 „Wir haben großes Interesse daran, herauszufinden, welche genetischen Faktoren die Resultate nach der CAR-T-Zell-Infusion beeinflussen können“, merkte er an.
Lymphomzellen sind in ihrem Überleben von der Methyltransferase EZH2 abhängig. Basierend auf der Hypothese, dass die Inhibition von EZH2 den Anti-Tumor-Effekt der CAR-T-Zellen verstärken und die Immunogenität von Lymphomen erhöhen könnte, verglichen Porazzi et al. eine CAR-T-Zell-Therapie plus dem EZH2-Inhibitor Tazemostat mit einer alleinigen CAR-T-Zell-Therapie an Lymphomzelllinien, wobei sich ihre Vermutungen bestätigten. In einer retrospektiven Untersuchung einer Kohorte mit B-Zell-Lymphomen (n=81) wurde darüber hinaus herausgefunden, dass Patient:innen mit einer aktivierenden EZH-Mutation im Vergleich zu jenen mit EZH-Wildtyp ein reduziertes Ansprechen auf CAR-T-Zellen hatten (14,3 vs. 42,3%).12 „Die Inhibition von EZH2 kann auch eine Modulation der Mikroumgebung sowie eine Erhöhung der T-Zell-Funktion bewirken“, berichtete Ruella über eigene Forschungsergebnisse.
Darüber hinaus sprach er über das Thema „T-Zell-Lymphome nach CAR-T-Zell-Therapie“. Dieses rückte durch eine im November 2023 publizierte Warnung der FDA13 ins Rampenlicht. Schon während des anschließenden Kongresses der American Society of Hematology (ASH) führte die Arbeitsgruppe um Ruella eine retrospektive Untersuchung dazu durch: Von 449 Patient:innen hatten nach einer CAR-T-Zell-Therapie zwölf Patient:innen solide Tumoren und fünf hämatologische Malignome entwickelt, die mediane Zeitspanne bis zum Auftreten lag bei 26,4 Monaten bei soliden bzw. 9,7 Monaten bei hämatologischen Neoplasien. Das einzige T-Zell-Lymphom, das nachgewiesen werden konnte, wurde im Lymphknotenbiopsat eines Patienten, der gleichzeitig ein Lungenkarzinom entwickelt hatte, diagnostiziert.14 „Diese Zahl an Sekundärmalignomen ist niedriger, als wir sie nach Transplantationen oder nach Chemotherapie beobachten, und natürlich hatten all diese Patient:innen zuvor mehrere Chemotherapien erhalten“, entschärfte Ruella die FDA-Warnung.
CAR-T-Zell-Therapie-assoziierte Toxizitäten
Eine eigene Session war dem Toxizitätsmanagement gewidmet, darin referierte Dr. Bianca Santomasso, Memorial Sloan Kettering Cancer Center, New York, über das „immune effector cell-associated neurotoxicity syndrome“ (ICANS) und PD Dr. Kai Rejeski, Ludwig-Maximilians-Universität, München, über „immune effector cell-associated hematotoxicity“ (ICAHT).
ICANS: mannigfaltige neurotoxische Symptome
Im Gegensatz zum CRS, bei dem mit Interleukin-6-Rezeptor-Blockade rasch eine Rückbildung der Symptome erzielt werden kann, sind Interleukin-6-Rezeptor-Inhibitoren bei ICANS nicht effektiv. Die bei ICANS auftretenden neurotoxischen Symptome umfassen Wortfindungsstörungen/Aphasie, Tremor, Somnolenz, epileptische Anfälle, motorische Schwäche, zerebrales Ödem, aber auch die Entwicklung einer CAR-T-Zell-assoziierten globalen Enzephalopathie (CRES) ist charakteristisch. Die Symptome variieren von Patient:in zu Patient:in. In der Regel tritt die Neurotoxizität während bzw. meistens nach einem CRS auf und bildet sich ohne bleibende Defizite wieder zurück.
Die Gruppe um Santomasso hat ein Screening-Tool zur Erfassung der Ausprägung der CAR-T-Zell-assoziierten Enzephalopathie entwickelt, das die Domänen „Orientierung“, „Benennung“, „Befolgen von Kommandos“, „Schreiben“ und „Aufmerksamkeit“ umfasst. Entsprechend der Ausprägung erfolgt eine Zuordnung von Punkten, der Score umfasst eine Skala von 1–10 und wurde in den Grading-Score der American Society for Transplantation and Cellular Therapy (ASTCT) integriert.15
Hämatotoxizität: häufigste CAR-T-ZellTherapie-bedingte Nebenwirkung
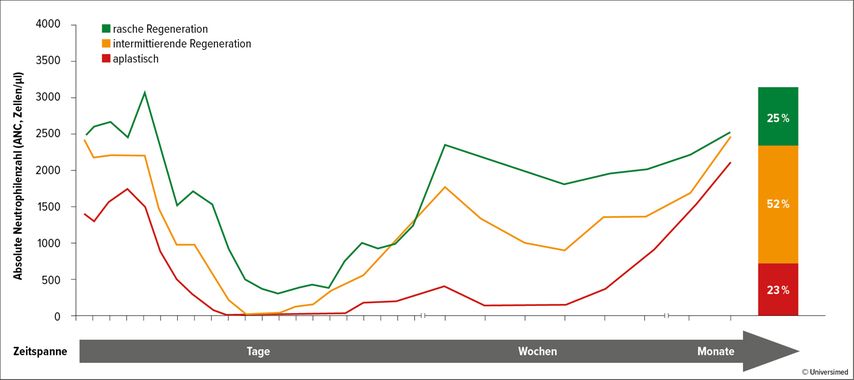
Mit 57,7% weist Hämatotoxizität von allen CAR-T-Zelltherapie-assoziierten Nebenwirkungen die höchste kumulative Inzidenz auf. Sie wird in den meisten Fällen als Grad ≥3 eingestuft. Der Verlauf der CAR-T-Zell-assoziierten Neutropenie ist biphasisch, wobei zwischen drei Phänotypen unterschieden wird (Abb. 2):17
-
rasche Regeneration: anhaltende Neutrophilenregeneration ohne zweiten Abfall der absoluten Neutrophilenzahl (ANC <1000/µl)
-
intermittierende Regeneration: Neutrophilenregeneration (ANC >1500/µl) nach Tag 21
-
aplastisch: kontinuierliche schwere Neutropenie (ANC <500/µl) für ≥14 Tage
Der klinische Phänotyp der Neutrophilenregeneration hat eine signifikante Auswirkung auf die mediane Dauer der schweren Neutropenie. Dementsprechend weist der aplastische Phänotyp das höchste Risiko für die Entwicklung von schweren Infektionen auf.17
Rajeski et al. identifizierten Risikofaktoren für die Entwicklung dieses Phänotyps und fanden dabei heraus, dass Thrombozytenspiegel, ANC und Hämoglobin als hämatologische Parameter, aber auch der inflammatorische Status – C-reaktives Protein (CRP) und Ferritin zu Baseline (vor Infusion der CAR-T-Zellen) – aussagekräftige Parameter darstellen. Diese Faktoren bilden die Basis für den CAR-HEMATOTOX-Score, einen Risikokalkulator für die Prädiktion von schweren Hämatotoxizitäten, der die Patient:innen in eine Niedrig- und eine Hochrisikogruppe („HTlow“: 0–1/„HThigh“: 2–7) unterteilt. Der Score wurde in einer europäischen und einer US-amerikanischen Kohorte validiert. Tatsächlich konnte festgestellt werden, dass HThigh-Patient:innen häufiger den aplastischen Phänotyp aufweisen und eine längere Dauer einer schweren Neutropenie haben.17 Außerdem konnte bestätigt werden, dass schwere Neutropenien mit schweren Infektionen assoziiert sind und „HThigh“-Patient:innen per se ein höheres Risiko für die Entwicklung von schweren Neutropenien aufweisen. Für die klinische Praxis bedeutet das, dass durch Bestimmung des Risikos auch entsprechende prophylaktische antiinfektive Maßnahmen getroffen werden können. Bei „HThigh“-Patient:innen konnte durch eine antibakterielle Prophylaxe die Wahrscheinlichkeit für schwere bakterielle Infektionen signifikant reduziert werden. Zusätzlich konnte gezeigt werden, dass „HThigh“- im Vergleich zu „HTlow“-Patient:innen ein kürzeres PFS (3,4 vs. 12,6 Monate) und OS (9,1 Monate vs. nicht erreicht) aufweisen und länger hospitalisiert waren (20 vs. 16 Tage).18
Die German Lymphoma Alliance (GLA) stellt den CAR-HEMATOTOX-Score als Online-Tool zur Verfügung, sodass die Risikogruppe der Patient:innen durch Eingabe der entsprechenden Parameter auf einfache Weise berechnet werden kann.19
Quelle:
6. EBMT-EMA CAR-T-cell Meeting, 15.–17. Februar 2024, Valencia, Spanien (hybrid)
Literatur:
1 Bachy E et al.: Nat Med 2023; 28(10): 2145-54 2 Kwon M et al.: Haematologica 2023; 108(1): 110-21 3 Jallouk AP et al.: Haematologica 2023; 108(4): 1163-7 4 Roddie C et al.: Blood Adv 2023; 7(12): 2872-83 5 Lickefett B et al.: Front Immunol 2023; 14: 1303935 6 Hirayama VA et al.: Blood 2019; 133(17): 1876-87 7 Dekker L et al.: Blood Adv 2022; 6: 1969-76 8 Scordo M et al.: Blood Adv 2023; 7(18): 5579-85 9 Ghilardi G et al.: Ann Oncol 2022; 33: 916-28 10 Ghilardi G et al.: Blood Adv 2024; 33(9): 916-28 11 Ghilardi G et al.: Br J Hematol 2021; 193: 449-6512 Porazzi P et al.: ASH 2023; Abstr. #1018 13 FDA: 28. November 2023. Online unter https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/fda-investigating-serious-risk-t-cell-malignancy-following-bcma-directed-or-cd19-directed-autologous . Abgerufen am 2. März 2024 14 Ghilardi G et al.: Nat Med 2024; online ahead of print 15 Lee DW et al.: Biol Blood Marrow Transplant 2019; 25(4): 625-38 16 Wudhikarn K et al.: Blood Adv 2020; 4(13): 3024-33 17 Rejeski K et al.: Blood 2021; 138(24): 2499-513 18 Rejeski K et al.: J Immunother Cancer 2022; 10(5): e00447519 German Lymphoma Alliance: 2024. Online unter https://www.german-lymphoma-alliance.de/Scores . Abgerufen am 3. März 2024
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
EHA 2018 NEWSROOM CH
… Unser Universimed-Team ist für Sie in Stockholm! Die European Hematology Association (EHA) macht dieses Jahr von 14. bis 17. Juni in Stockholm Halt und versammelt Experten aus Europa ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1