Molekularpathologie für die gynäkologische Onkologie
Autor:
Prim. Univ.-Prof. Dr. Sigurd F. Lax
Institut für Klinische Pathologie und Molekularpathologie
LKH Graz II
Akademisches Lehrkrankenhaus der
Medizinischen Universität Graz
Medizinische Fakultät
Johannes-Kepler-Universität Linz
E-Mail: sigurd.lax@kages.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Im Bereich der gynäkologischen Onkologie kam es in den letzten Jahren zu wesentlichen Veränderungen in der Therapie, basierend auf wesentlichen Erkenntnissen aus klinisch-pathologischen Forschungsergebnissen. Speziell davon betroffen sind das Endometriumkarzinom und das Ovarialkarzinom, weniger ausgeprägt das Zervixkarzinom.
Molekulare Klassifikation des Endometriumkarzinoms
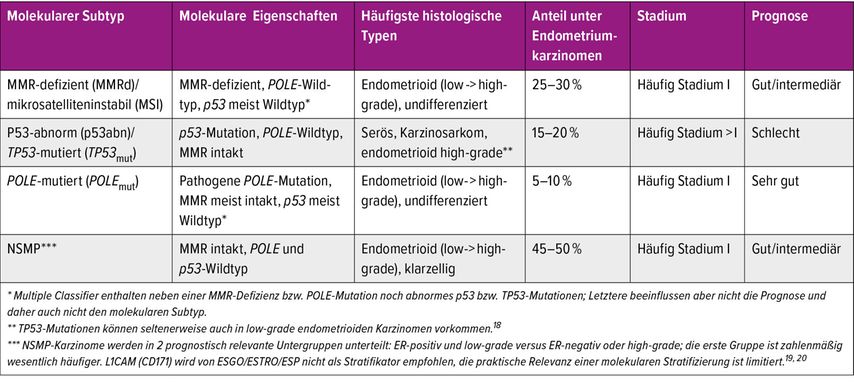
Für das Endometriumkarzinom hat sich im Zuge der WHO-Klassifikation der Tumoren 2020 eine molekulare Klassifikation etabliert, die ursprünglich nur für den endometrioiden histologischen Typ vorgesehen war. Diese molekulare Klassifikation wurde in den letzten fünf Jahren von namhaften wissenschaftlichen Organisationen wie der European Society of Gynecological Oncology (ESGO), der European Society for Radiotherapy and Oncology (ESTRO), der European Society of Pathology (ESP), der European Society for Medical Oncology (ESMO) und der International Federation of Gynecology and Obstetrics (FIGO) übernommen und in Empfehlungen und Richtlinien integriert.1–4 ESGO, ESTRO und ESP haben im vergangenen Jahr ihre gemeinsamen Empfehlungen wesentlich überarbeitet und verfeinert. Die molekulare Klassifikation wird dabei für alle Endometriumkarzinome empfohlen und sollte am besten im Zuge der Erstdiagnostik am Kürettagematerial erstellt werden. Die molekulare Klassifikation basiert ursprünglich auf den Ergebnissen des Cancer-Genome-Atlas-Projektes (TGCA), das mittels Next-Generation-Sequencing (NGS) vier prognostisch unterschiedliche Subtypen des Endometriumkarzinoms darstellen konnte. Die Anwendung von Surrogatmarkern hat die Untersuchung vereinfacht und praxistauglich gemacht. Die Klassifikation basiert auf folgenden Untersuchungen: Immunhistochemie mit Antikörpern gegen Östrogenrezeptoren, p53 und Mismatch-Repairproteine sowie eine molekulare Untersuchung auf pathogene Polymerase-E (POLE)-Mutationen. Basierend auf diesen Untersuchungen ergeben sich schließlich vier unterschiedliche Subtypen (Tab. 1). Mithilfe der Untersuchungen werden drei wesentliche Alterationen detektiert: eine Mismatch-Repair-Defizienz (MMRd) oder eine abnorme p53-Expression bzw. TP53-Mutationen und pathogene POLE-Mutationen. Fehlen diese drei Alterationen spricht man von „No specific molecular profile“(NSMP)-Karzinomen, die mit etwa 50% die größte Gruppe darstellen. NSMP-Karzinome werden auf Basis des Östrogenrezeptors und des histopathologischen Differenzierungsgrades in zwei Subgruppen unterteilt (Tab. 1). Der molekulare Typ hat eine wesentliche prognostische Aussagekraft, sagt aber auch das Ansprechen auf Therapieoptionen vorher. Dazu zählt insbesondere das Ansprechen auf eine Immuncheckpoint-Inhibition bzw. Therapie mit Immunonkologika bei MMR-defizienten und auch bei POLE-mutierten Karzinomen. P53-abnorme Karzinome sprechen wiederum gut auf eine Radio-Chemotherapie an, während diese bei POLE-mutierten Karzinomen kaum Wirkung zu zeigen scheint. Für Karzinome mit TP53-Wildtyp gibt es ebenfalls eine neue Therapie, speziell für fortgeschrittene Stadien und Rezidive.
All diese Erkenntnisse sind in die revidierten ESGO/ESTRO/ESP-Guidelines eingegangen.4 Diese sehen für High-Risk-Karzinome eine adjuvante Therapie mit Immunonkologika vor, ebenso eine kombinierte Chemo-Immunonkologika-Therapie für fortgeschrittene und rezidivierte Endometriumkarzinome bereits in der Erstlinie, bevorzugt für den dMMR-Typ. Hier hat die MMR-Testung eine wesentliche Bedeutung für die Behandlung. In der Zweitlinie nach erfolgloser Chemotherapie werden fortgeschrittene und rezidivierte Endometriumkarzinome mit dMMR- sowie mit pMMRbzw. Nicht-dMMR-Status mit Immunonkologika therapiert.4
Testung: „one stop shop“ und qualitätsgesichert
Die Testempfehlung sieht die Untersuchung aller wesentlicher Parameter auf einmal vor. Dazu zählen immunhistochemische Untersuchungen für Östrogenrezeptoren, p53 sowie die beiden Mismatch-Repairproteine MSH6 und PMS2.5 Die MMR-Proteine bilden Dimere (MLH1-PMS2 und MSH2-MSH6) mit jeweils einem größeren (MLH1 bzw. MSH2) und einem kleineren (PMS2 bzw. MSH6) Partner. Während ein Ausfall der größeren Partner auch zu einem Ausfall der kleineren Partner führt, bleiben bei einem Ausfall der kleineren Partner die größeren Partner intakt. Im Falle des Ausfalls eines der beiden Mismatch-Repairproteine würde man daher in einem nächsten Schritt den jeweiligen großen Partner (MLH1 bzw. MSH2) untersuchen. Dies ist effizienter, als alle vier MMR-Proteine auf einmal zu untersuchen. Bei einem Ausfall von MLH1 gilt es, eine Methylierung des MLH1-Promotors auszuschließen. Die Methylierung des MLH1-Promotors ist die häufigste Ursache für einen Ausfall von MLH1 und betrifft etwa 90% derMLH1-defizienten Fälle. Die nicht überall verfügbare Untersuchung auf Methylierung (sogenannter Methylierungs-Assay) kann mittlerweile auch durch eine immunhistochemische Untersuchung mit Antikörpern gegen EPM2AIP1 (dies ist ein Surrogatmarker) ersetzt werden.6 Das Gen für EPM2AIP1 liegt dem MLH1-Gen benachbart und daher kommt es im Falle einer Methylierung von MLH1 zu einem kombinierten Ausfall von EPM2AIP1. Bei fehlender Methylierung gilt es, eine Mutation von MLH1 auszuschließen, wobei somatische Mutationen von MLH1 im Tumor häufiger sind als Keimbahnmutationen. Der Ausfall der übrigen drei MMR-Proteine erfordert immer den Ausschluss einer Keimbahnmutation, der verbunden mit Familienanamnese und genetischer Beratung durchgeführt werden sollte, dies ist auch bei den nicht durch Methylierung bedingten Ausfällen von MLH1 erforderlich.
Speziell die MMR-Immunhistochemie erfordert ein standardisiertes Vorgehen auf einer standardisierten und qualitativ hochwertigen Plattform. Es ist empfehlenswert, standardisierte, IVD-zertifizierte Antikörper zu verwenden. Außerdem ist der Einsatz von On-Slide-Kontrollen ratsam, ebenso wie die regelmäßige Teilnahme an Ringversuchen. Ganz wesentlich für die präanalytische Phase sind die Dauer der Fixierung und die Wahl eines optimalen Fixans (z.B. gepuffertes 4%iges Formalin). Die MMR-Proteine können diagnostische Probleme nach sich ziehen, wie eine punktförmige Färbung, die als falsch positiv interpretiert werden kann. Das Phänomen einer heterogenen Färbung wurde in der Literatur mehrfach untersucht und kann Ausdruck einer MMR-Defizienz sein. Im Zuge der Durchführung ergänzender PCR-Untersuchungen auf Mikrosatelliteninstabilität ist es dabei notwendig, einen ausreichend hohen Tumorzellgehalt zu verwenden (40% und mehr werden empfohlen) und ebenso die immunhistochemisch negativen Areale zu mikrodissezieren.7
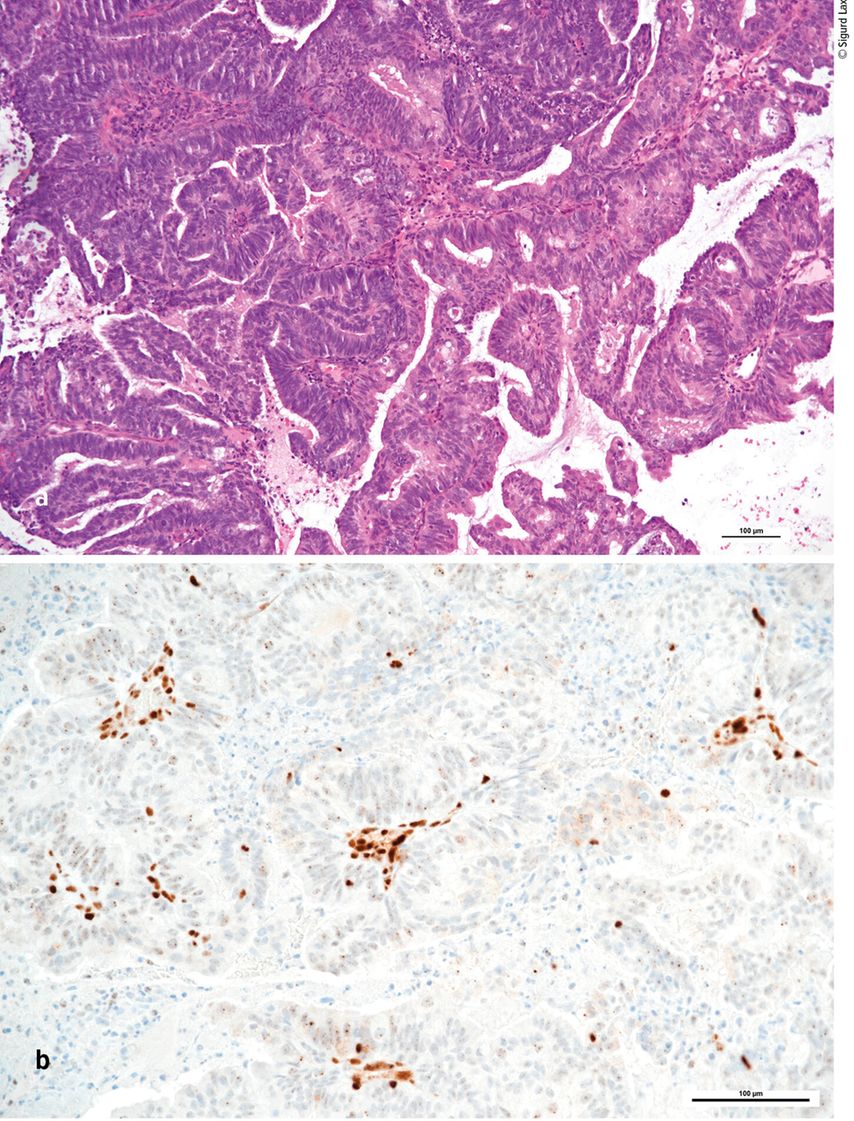
Abb. 1: Gut differenziertes (low-grade/Grad 1) endometrioides Endometriumkarzinom (a) mit immunhistochemischem Verlust von MLH1 infolge von Promotor-Methylierung (b). Die Stromazellen zeigen eine intakte Immunreaktivität für MLH1. HE (a) und DAB (b), Originalvergrößerung 200-fach
Die POLE-Mutationsanalyse kann sowohl durch NGS als auch durch ein Real-Time-PCR-basiertes Verfahren durchgeführt werden. Derzeit kennt man 17 pathogene Varianten von POLE (früher auch als Mutationen bezeichnet) im Bereich von elf Loci. Diese finden sich alle im Bereich der Exonuklease-Domäne von POLE, einem wesentlichen Reparaturenzym der DNA. Die häufigsten fünf Mutationen finden sich in etwa 95% der POLE-mutierten Karzinome. Physiologischerweise erkennt POLEPunktmutationen, die in der Folge repariert werden; dies wird auch als „proofreading“ bezeichnet. Bei POLE-mutierten Tumoren kommt es daher zu vielen Tausenden von Mutationen im Genom, die als Passenger(Passagier)-Mutationen einzustufen sind. Durch Produktion von Neuantigenen wird das körpereigene Immunsystem wesentlich stimuliert, was offensichtlich zu einer Immunreaktion gegen den Tumor führt. POLE-mutierte Tumoren können beispielsweise auch TP53-Mutationen aufweisen, die ihrerseits im Sinne von Passenger-Mutationen aber keinen wesentlichen Einfluss auf den Verlauf der Tumorerkrankung haben. Tumoren mit Veränderungen sowohl im Bereich von TP53 als auch im Bereich von MMR-Proteinen und POLE werden als „multiple classifier“ bezeichnet (Tab. 1). Es ist wichtig, dass deren Prognose wesentlich besser ist als jene von Karzinomen ausschließlich mit TP53-Mutation.
HER2: Bedeutung auch beim Endometriumkarzinom
Ein weiteres und zunehmend wichtiges Target beim Endometriumkarzinom ist HER2, das sich speziell in Endometriumkarzinomen mit abnormer p53-Expression findet; dies sind am häufigsten seröse Karzinome, außerdem Karzinosarkome und schlecht differenzierte endometrioide Karzinome. Insgesamt zeigen etwa 4% aller Endometriumkarzinome, 6–8% aller Endometriumkarzinome mit hohem Risiko für ein Rezidiv bzw. bis zu 50% aller serösen Endometriumkarzinome eine HER2-Überexpression bzw. Amplifikation.8,9 In der Praxis wird es ratsam sein, die Auswahl für die Untersuchung von Tumoren auf HER2 im Tumorboard zu treffen. Für die Auswertung gibt es derzeit noch kein einheitliches Scoring-System, insbesondere fehlen Daten aus prospektiv randomisierten Studien.10 Vorschläge für das Scoring beziehen sich auf ein modifiziertes System ähnlich jenem beim Mammakarzinom oder eine Anlehnung an die Auswertung bei gastrointestinalen Karzinomen. In diesem Bereich gibt die ESGO/ESTRO/ESP-Leitlinie keine Empfehlung. Ob ein HER2-low-Status, der sich beim Endometriumkarzinom in 15–20% der Fälle findet, eine Rolle spielen wird, ist noch unklar. Ein therapeutisch noch nicht verwendetes Target sind erbB2-Mutationen, die sich in etwa 2,5% aller Endometriumkarzinome finden und teilweise mit einer Genamplifikation assoziiert sind.11
Molekularpathologische Untersuchungen beim Ovarialkarzinom
Für das Ovarialkarzinom stellt die Untersuchung auf BRCA1- und -2-Mutationen sowie auf Defekte im Bereich der homologen Rekombination (HRD=homologe Rekombinationsdefizienz) einen wesentlichen therapierelevanten Schritt dar und sollte bei allen nichtmuzinösen Karzinomen im Rahmen der Erstdiagnostik durchgeführt werden.12BRCA1- oder -2-mutierte bzw. HRD-positive Ovarialkarzinome können effizient mittels PARP-Inhibitoren behandelt werden. Durch die BRCA-Mutationen bzw. HRD fallen wesentliche DNA-Reparaturmechanismen im Speziellen zur Behebung von Doppelstrangbrüchen aus. Die PARP-Inhibition führt zur Blockade des verbleibenden Einzelstrang-Reparaturmechanismus bei defektem Doppelstrang-Reparaturmechanismus und führt somit zum Tod der Tumorzellen. Die Untersuchung am Tumorgewebe, die mittlerweile dezentral in vielen Pathologieinstituten erfolgt, ermöglicht, diesen Meilenstein in der Therapie praktisch umzusetzen. Mittlerweile sind anhand von Studienmaterial validierte, gut praktikable und robuste Tests verfügbar. Dazu zählt der NOGGO-GIS-Test, der anhand eines Kollektivs der PAOLA-1-Studie durchgeführt und mit den Ergebnissen des Myriad MyChoice®-Tests verglichen wurde.13 Dieser Assay beinhaltet auch eine Reihe anderer wesentlicher Gene, die im Zuge der Ovarialkarzinome mutiert sein können und praktische Relevanz aufweisen. Eine HRD-Untersuchung beinhaltet aber auch die großen Panels, die von der Industrie angeboten werden (z.B. TSO500, OCA plus).14
Wichtig zu erwähnen ist auch die Empfehlung vonseiten der europäischen Fachgesellschaften ESGO, ESMO und ESP, endometrioide und klarzellige Endometriumkarzinome auf MMR-Defizienz bzw. Mikrosatelliteninstabilität hin zu untersuchen.12 Auch hier bietet sich potenziell die Möglichkeit einer therapeutischen Immuncheckpoint-Inhibition, wobei dazu aber weniger klinische Daten vorliegen als beim Endometriumkarzinom. Außerdem kann durch MMR/MS-Analyse ein Lynch-Syndrom ausgeschlossen werden.
Molekularpathologische Untersuchungen beim Zervixkarzinom
Die diagnostische Molekularpathologie beschränkt sich im Wesentlichen auf die Feststellung des HPV-Bezugs eines Karzinoms. Dies wird standardmäßig mittels p16-Immunhistochemie bzw. alternativ mittels HPV-in-situ-Hybridisierung durchgeführt.15 Von therapeutischer Bedeutung ist die Expression von PD-L1, die sich je nach histologischem Typ in 50–100% der Zervixkarzinome und in 90% der Plattenepithelkarzinome der Zervix finden.16 Die Suche möglicher therapeutischer Targets mittels NGS spielt derzeit hingegen nur eine beschränkte Rolle. HPV-assoziierte Karzinome können KRAS- und PIK3CA-Mutationen mit einer Fehlregulation des PI3K/Akt/mTOR- und des MAPK-Signaltransduktionswegs aufweisen. In den HPV-unabhängigen Adenokarzinomen finden sich verschiedenste Mutationen in den Genen TP53, KRAS, RP2, STK11. In den neuroendokrinen Karzinomen können ebenfalls Gene der PI3K/Akt/mTOR- und MAPK-Signaltransduktionswege mutiert sein, sich aber auch TP53 und BRCA1/2-Mutationen finden. HPV-unabhängige Plattenepithelkarzinome scheinen speziell Mutationen in den Genen KRAS,ARID1A, PTEN und TP53 aufzuweisen.15
Literatur:
1 Berek JS et al.: FIGO staging of endometrial cancer: 2023. Int J Gynaecol Obstet 2023; 162(2): 383-94 2 Bosse T et al.: Endometrioid carcinoma of the uterine corpus, in WHO Classification of Tumours Editorial Board. Female genital tumours. X. Matias-Guiu and S.F. Lax, Editors. International Agency for Research of Cancer: Lyon (France),20203 Concin N et al.: ESGO/ESTRO/ESP Guidelines for the management of patients with endometrial carcinoma. Virchows Arch 2021; 478(2): 153-90 4 Concin N et al.: ESGO–ESTRO–ESP guidelines for the management of patients with endometrial carcinoma: update 2025. Lancet Oncol 2025; 26: e423-35 5 Vermij L et al.: p53 immunohistochemistry in endometrial cancer: clinical and molecular correlates in the PORTEC-3 trial. Mod Pathol 2022; 35(10): 1475-83 6 Gatius S et al.: EPM2 AIP1 immunohistochemistry as a surrogate of promoter methylation analysis in endometrial carcinoma. Virchows Arch 2025; doi: 10.1007/s00428-025-04132-3 7 Ruschoff J et al.: Mismatch repair and microsatellite instability-Recommendation for an optimal test strategy. Cancer 2024; 130(9): 1711-2 8 Ross DS et al.: Histopathologic features and molecular genetic landscape of HER2-amplified endometrial carcinomas. Mod Pathol 2022; 35(7): 962-71 9 van Dijk D et al.: Clinical and molecular characteristics of high-risk, recurrent, or metastatic endometrial cancer that is human epidermal growth factor receptor 2-low. J Clin Oncol 2025; 43(4): 443-52 10 Buza N: The rapidly evolving landscape of human epidermal growth factor receptor 2 (HER2) testing in tndometrial carcinoma and other gynecologic malignancies. Arch Pathol Lab Med 2025; doi: 10.5858/arpa.2025-0046-RA 11 Brodeur MN et al.: ERBB2 mutations define a subgroup of endometrial carcinomas associated with high tumor mutational burden and the microsatellite instability-high (MSI-H) molecular subtype. Mol Oncol 2024; 18(10): 2356-68 12 Ledermann JA et al.: ESGO-ESMO-ESP consensus conference recommendations on ovarian cancer: pathology and molecular biology and early, advanced and recurrent disease. Ann Oncol 2024; 35(3): 248-66 13 Willing EM et al.: Development of the NOGGO GIS v1 assay, a comprehensive hybrid-capture-based NGS assay for therapeutic stratification of homologous repair deficiency driven tumors and clinical validation. Cancers (Basel) 2023; 15(13): 3445 14 Roma C et al.: Harmonization of homologous recombination deficiency testing in ovarian cancer: Results from the MITO16A/MaNGO-OV2 trial. Eur J Cancer 2024; 206: 114127 15 Herrington CS: Tumors of the uterine cervix in WHO Classification of Tumours. Female genital tumours. International Agency for Research on Cancer (IARC): Lyon (France), 2020. 336-89 16 Huang RSP et al.: Clinicopathologic and genomic characterization of PD-L1-positive uterine cervical carcinoma. Mod Pathol 2021; 34(7): 1425-33 17 Huvila J et al.: Endometrial carcinoma: molecular subtypes, precursors and the role of pathology in early diagnosis. J Pathol 2021; 253(4): 355-65 18 Jamieson A et al.: Clinical behavior and molecular landscape of stage I p53-abnormal low-grade endometrioid endometrial carcinomas. Clin Cancer Res 2023; 29(23): 4949-57 19 Momeni-Boroujeni A et al.: Genomic landscape of endometrial carcinomas of no specific molecular profile. Mod Pathol 2022; 35(9): 1269-78 20 Vermij L et al.: Prognostic refinement of NSMP high-risk endometrial cancers using oestrogen receptor immunohistochemistry. Br J Cancer 2023; 128(7): 1360-8
Das könnte Sie auch interessieren:
Unser Universimed-Team berichtet für Sie aus Salzburg!
Die Jahrestagung der OEGGG findet in diesem Jahr vom 30. Mai bis 2. Juni in Salzburg statt. Diese Veranstaltung ist zweifelsohne eine der bedeutendsten Tagungen für Gynäkologinnen und ...
OeGGG 2018
...
OeGGG 2018
Test...