Pankreaszysten als differenzialdiagnostische Herausforderung
Autoren:
Dr. med. Christoph Kümmerli
PD Dr. med. Philip C. Müller
Prof. Dr. med. Adrian T. Billeter, PhD
Prof. Dr. med. Beat P. Müller
Viszeralchirurgie
Clarunis – Universitäres Bauchzentrum Basel
Korrespondenz:
Prof. Dr. med. Beat P. Müller
E-Mail: beat.mueller@clarunis.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der Begriff zystische Pankreasneoplasie fasst eine heterogene Gruppe von Pankreasveränderungen zusammen. Sie zeigen jeweils variable biologische Verhaltensweisen mit unterschiedlichem Risiko für eine maligne Transformation. Die Unterscheidung des Zystentyps sowie das entsprechende Transformationsrisiko sind herausfordernd und erfordern umfassende Abklärungen. Hierfür stehen neben den klinischen Angaben bildgebende Verfahren und die endoskopische Diagnostik zur Gewebegewinnung zur Verfügung. Bei Pankreaszysten mit Hinweisen auf eine Transformation lässt sich eine Präkanzerose nur durch die chirurgische Resektion kurativ behandeln. Dafür kommen insbesondere neue, roboterassistierte und gleichzeitig organerhaltende Operationstechniken infrage.
Keypoints
-
Diagnosestellung und Einschätzung des Transformationsrisikos sind bei zystischen Pankreasneoplasien herausfordernd und bedürfen einer Zentrumsbehandlung.
-
Anamnese, Tumormarker, Bildgebung und Feinnadelpunktion bilden die Grundlage der Diagnostik. Relevant ist ein engmaschiges Follow-up (3–12 Monate) zur Verlaufsbeurteilung.
-
Bei frühzeitiger Diagnosestellung und operativer Entfernung können Präkanzerosen mit exzellenten Langzeitergebnissen kurativ behandelt werden.
-
Roboterassistierte Verfahren ermöglichen eine schonende und organerhaltende Zystenentfernung.
Zystische Pankreasneoplasien (ZPN) sind eine heterogene Gruppe von Veränderungen, welche aufgrund der hochauflösenden Bildgebung immer häufiger diagnostiziert werden. Mittels moderner Schnittbildgebung fallen solche Veränderungen des Pankreas bei ca. 8% der Untersuchungen auf, oftmals als Zufallsbefund.1Grund hierfür sind häufiger durchgeführte Bildgebungen und die höhere Auflösung moderner Geräte. Die vier häufigsten Entitäten sind intraduktale papillär-muzinöse Neoplasien (IPMN) mit Haupt- oder Seitengangbeteiligung, muzinös-zystische Neoplasien (MCN), serös-zystische Neoplasien (SCN) und solid-pseudopapilläre Neoplasien (SPN). Die Unterscheidung der einzelnen zystischen Veränderungen ist eine Herausforderung, prognostisch jedoch hoch relevant, da IPMN und MCN im Vergleich zu den anderen zystischen Raumforderungen Vorläuferläsionen für ein Pankreaskarzinom sein können. Erschwerend kommt hinzu, dass die Vorhersage, welche Neoplasie ein malignes Transformationspotenzial hat, zurzeit noch relativ ungenau ist.
Entwickelt sich aus einer ZPN ein invasives Karzinom, dann ist die Prognose der ZPN der des Pankreaskarzinoms gleichzusetzen. Sofern eine Resektion überhaupt noch möglich ist, liegt die 5-Jahres-Überlebensrate unter 40%.2
Diagnose durch multidisziplinäre Zusammenarbeit
Erste Hinweise auf die Diagnose ergeben neben Alter, Geschlecht und Lokalisation der Zyste vor allem eine pankreasspezifische Anamnese (Tab. 1). Hierbei ist es wichtig, zu erfragen, ob familiäre Pankreaskarzinome bekannt sind und ob in der Vergangenheit Pankreatitiden, endo- und exokrine Insuffizienzen und Ikterus aufgetreten sind. Für IPMN sollte der Tumormarker CA19-9 routinemässig kontrolliert werden, wobei die Sensitivität niedrig und die Spezifität hoch ist (52% vs. 88%).3
Die Bildgebung ist meist als erste Diagnostik vorhanden, da die ZPN oft als Zufallsbefund entdeckt wird (Abb. 1). Die Bildgebung stellt zwar das wichtigste diagnostische Mittel dar, lässt aber nur eine grobe Zuteilung zu den unterschiedlichen Zystentypen zu. Die Magnetresonanztomografie ist der Computertomografie bei der Vorhersage von Malignität bei zystischen Neoplasien mit einer Genauigkeit von 51% gegenüber 44% überlegen.4
Abb. 1: MRI-Befunde der häufigsten zystischen Pankreasneoplasien. A) intraduktale papillär-muzinöse Neoplasie (IPMN) des Hauptgangs; B) Seitengang-IPMN; C) muzinös-zystische Neoplasie (MCN); D) serös-zystische Neoplasie (SCN); E) solid-pseudopapilläre Neoplasie (SPN)
Die Endosonografie stellt einen weiteren bildgebenden Pfeiler in der Diagnostik dar, kommt jedoch erst zum Einsatz, wenn die vorangegangene Bildgebung nicht konklusiv ist und eine Gewebeprobe erforderlich wird. Zusätzlich lässt sich so auch eine Feinnadelpunktion (FNP) bzw. Untersuchung der Zystenflüssigkeit durchführen. Die Gewebegewinnung lässt zwischen muzinösen Neoplasien (IPMN und MCN) und nichtmuzinösen Neoplasien unterscheiden. Zudem können allenfalls dysplastische oder maligne Zellen sowie Pankreasamylase oder Tumormarker (CEA: karzinoembryonales Antigen) in der Zystenflüssigkeit nachgewiesen werden. Weiterführende genetische Analysen wie z.B. KRAS- und GNAS-Mutationen der Zystenflüssigkeit können hinweisend auf eine maligne Transformation bei IPMN sein. Hier sind künftig die grössten diagnostischen Fortschritte zu erwarten. So könnten neue Biomarker sehr zuverlässig helfen, die Differenzierung unterschiedlicher Dysplasiegrade bei IPMN zu verbessern. In einer kürzlich erschienenen Studie aus Heidelberg konnte mithilfe von Protein- und MicroRNA-Analysen eine Genauigkeit der IPMN-Differenzierung von bis zu 95% erreicht werden.5
Behandlung – minimalinvasive Operation bis individuelle Überwachung
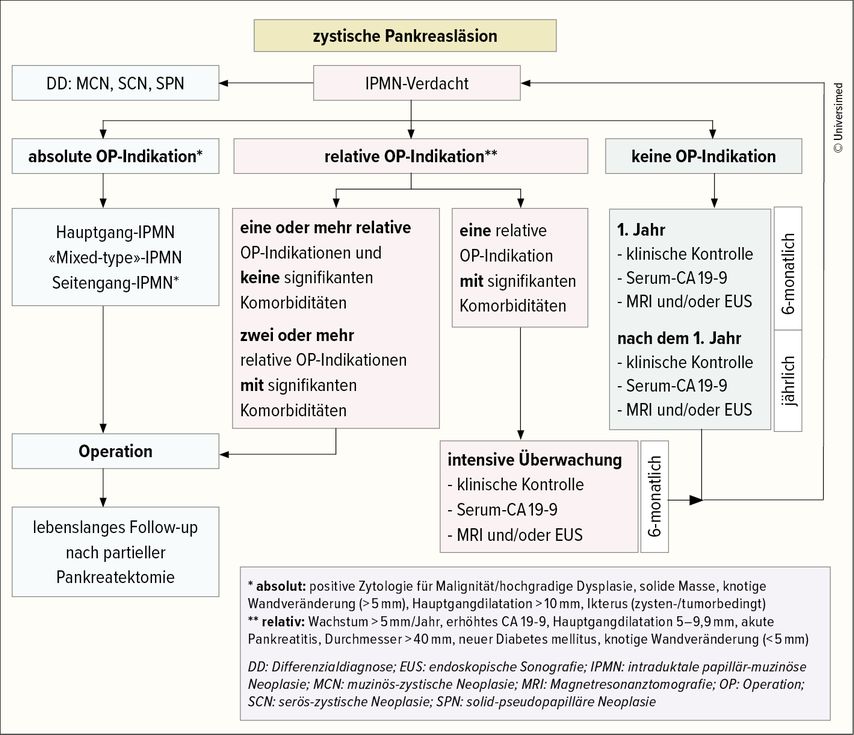
Das weitere Management richtet sich nach der Einschätzung, wie hoch das Risiko für eine maligne Entartung ist. Die European Study Group on Cystic Tumours of the Pancreas hat 2018 Empfehlungen hierzu veröffentlicht (Abb. 2).6,7
Abb. 2: Übersicht über das Management von zystischen Pankreasneoplasien (adaptiert nach The European Study Group on Cystic Tumours of the Pancreas 2016)6
Intraduktale papillär-muzinöse Neoplasien (IPMN)
Bei IPMN wird zwischen zystischen Läsionen mit Seiten- oder Hauptgangbeteiligung oder der Kombination davon («mixed type») unterschieden. Die Seitengang-IPMN präsentiert sich heterogen. Die Rate der malignen Transformationen unterliegt verschiedenen Charakteristika. Potenzielle Risikofaktoren müssen sorgfältig evaluiert werden, da selbst kleine IPMN hochgradige Dysplasien oder Krebs enthalten bzw. entwickeln können. Absolute Kriterien («high-risk stigmata») für die Resektion eines IPMN sind Ikterus, positive Zytologie für hochgradige Dysplasie respektive maligne Zellen, Erweiterung des Hauptganges ≥10mm, Wandknötchen ≥5mm oder das Vorhandensein einer soliden Masse im Pankreas. Relative Kriterien («worrisome features») für die Resektion von IPMN sind ein Zystendurchmesser ≥30mm, Wachstumsrate ≥5mm/Jahr, klinische Symptome wie akute Pankreatitis oder neu auftretender Diabetes mellitus, erhöhtes CA19-9, Erweiterung des Hauptganges ≥5mm oder knotige Veränderungen der Zystenwand <5mm.6 Patienten mit IPMN ohne Indikation für eine Operation sollten im ersten Jahr alle 1–6 Monate mit MRT und Tumormarkerkontrolle nachbeobachtet werden und bei unauffälliger Nachkontrolle im weiteren Verlauf jährlich. Bei Patienten mit einer relativen Operationsindikation wird eine 6-monatige Nachbeobachtung empfohlen. Wichtig ist, dass bei einer Veränderung der klinischen Symptome respektive dem Auftreten von solchen sowie einem Anstieg des CA19-9 eine umgehende Reevaluation erfolgt. Insgesamt macht die bildgebende Nachkontrolle jedoch nur Sinn, wenn eine operative Therapie überhaupt infrage kommt. Bei Patienten in schlechtem Allgemeinzustand, bei denen eine Pankreasresektion nicht infrage kommt, ist keine Verlaufskontrolle indiziert.
Eine Hauptgang-IPMN hat ein hohes Risiko für Malignität (Karzinome und High-grade-Dysplasie bis 70%) und sollte reseziert werden, sofern der Patient für eine Operation fit ist. «Mixed-type» IPMN, mit Anteilen von Haupt- und Seitengang-IPMN, haben ein ähnlich hohes Risiko für Malignität wie Hauptgang-IPMN und die Resektion wird daher ebenso empfohlen (Abb. 2).
Neuste Studien zeigen, dass die Beobachtung ausgewählter IPMN auch gestoppt werden kann. Bei fehlender absoluter und relativer Operationsindikation und einer stabilen Zystengrösse <15mm bei Patienten über 65 Jahre oder einer stabilen Zystengrösse <20mm bei Patienten über 75 Jahre kann die Beobachtung beendet werden, sofern 5 Jahre lang keine morphologische Veränderung der Zyste stattgefunden hat. Das Risiko für eine maligne Transformation hat sich dann demjenigen der Normalbevölkerung angeglichen.8,9
Muzinös-zystische Neoplasien (MCN)
Das Entartungsrisiko für MCN ist abhängig von der Grösse des Befundes, wobei ein Durchmesser von <4cm selten mit einer malignen Entartung assoziiert ist, während grössere Befunde in bis zu 34% Karzinome zeigen. Eine Resektion ist somit indiziert, wenn die zystische Läsion ≥40mm beträgt, der Patient symptomatisch ist oder wenn Risikofaktoren wie Wandknötchen vorhanden sind. In Abwesenheit der oben genannten Risikofaktoren kann die Follow-up-Bildgebung alle 6 Monate im ersten Jahr, danach jährlich erwogen werden. Zu beachten ist, dass im Entscheidungsprozess die MCN-Wachstumsrate berücksichtigt werden sollte.
Serös-zystische Neoplasien (SCN)
Die SCN stellen eine gutartige Entität dar, die krankheitsspezifische Mortalität ist nahezu null. Asymptomatische Patienten sollten ein Jahr lang nachbeobachtet werden, danach wird eine symptombasierte Nachsorge empfohlen. Trotz der langsamen Wachstumsrate treten selten Symptome aufgrund einer Kompression von benachbarten Organen auf. Hier kann eine Resektion zur Dekompression durchgeführt werden.
Solid-pseudopapilläre Neoplasien (SPN)
SPN als seltenste Entität betreffen vor allem junge Frauen und sollten reseziert werden, da sie eine niedrigmaligne Entität darstellen. Bei einer Resektion muss jedoch eine R0-Resektion erreicht werden, da die wenigen bekannten metastasierten Fälle alle mit einer R1-Resektion vergesellschaftet sind.10
Operation
Abb. 3: Bei frühzeitiger Diagnosestellung können Präkanzerosen mittels operativer Entfernung mit ausgezeichneten Langzeitergebnissen kurativ behandelt werden
Bezüglich der Operationstechnik stellen heutzutage die minimalinvasive roboterassistierte Resektion sowie die Enukleation, als organerhaltende Alternative, die bevorzugten Therapieoptionen bei fehlendem Hinweis auf ein Karzinom dar. Durch den minimalinvasiven Zugang der Roboterchirurgie können das Zugangstrauma und damit Schmerzen, Wundinfekte und Adhäsionen im Bauchraum deutlich reduziert werden, was sich in einer verkürzten Hospitalisationsdauer für den Patienten niederschlägt.11,12 Durch die zusätzlichen Freiheitsgrade der robotischen Instrumente, welche präziseres Arbeiten ermöglichen, und die hohe Auflösung mit dreidimensionaler Sicht lassen sich neue und schonende Pankreasoperationen durchführen. In gewissen Fällen lässt sich die Zyste bei der sogenannten Enukleation gezielt ausschälen und dadurch kann das Pankreas komplett erhalten werden. Sollte die Enukleation nicht möglich sein, kommen formale Resektionen wie die Pankreasschwanzresektion oder die Pankreatoduodenektomie zum Einsatz. Diese radikaleren Resektionen sind insbesondere bei Malignomverdacht zur adäquaten Lymphadenektomie indiziert.
So wichtig wie die Operation ist auch die anschliessende Nachsorge, solange der Patient fit genug und bereit ist, sich einer erneuten Operation zu unterziehen, falls indiziert. Der Grund hierfür ist, dass eine zystische Neoplasie Ausdruck einer karzinogenen Transformation des Pankreas ist.13 Somit besteht weiterhin ein höheres Risiko (ca. 10–20%) für die Entwicklung eines weiteren Malignoms, sofern keine totale Pankreatektomie vorgenommen wurde.
Literatur:
1 Zerboni G et al.: Systematic review and meta-analysis: Prevalence of incidentally detected pancreatic cystic lesions in asymptomatic individuals. Pancreatology 2019; 19: 2-9 2 Kaiser J et al.: IPMN-associated pancreatic cancer: Survival, prognostic staging and impact of adjuvant chemotherapy. Eur J Surg Oncol 2022; 48: 1309-20 3 Lee SW et al.: Comparison of preoperative imaging modalities for the assessment of malignant potential of pancreatic cystic lesions: A network meta-analysis. Clin Nucl Med 2022; 47: 849-55 4 Wang W et al.: Serum carcinoembryonic antigen and carbohydrate antigen 19-9 for prediction of malignancy and invasiveness in intraductal papillary mucinous neoplasms of the pancreas: A meta-analysis. Biomedical Reports 2014; 3: 43-50 5 Zhang C et al.: Blood-based diagnosis and risk stratification of patients with pancreatic intraductal papillary mucinous neoplasm (IPMN). Clin Cancer Res 2023; 29: 1535-45 6 The European Study Group on Cystic Tumours of the Pancreas: European evidence-based guidelines on pancreatic cystic neoplasms. Gut 2018; 67: 789-804 7 Ohtsuka T et al.: International evidence-based Kyoto guidelines for the management of intraductal papillary mucinous neoplasm of the pancreas. Pancreatology 2024; 24: 255-70 8 Marchegiani G et al.: Surveillance for presumed BD-IPMN of the pancreas: stability, size, and age identify targets for discontinuation. Gastroenterol 2023; 165: 1016-24 9 Han Y et al.: Optimal surveillance interval of branch duct intraductal papillary mucinous neoplasm of the pancreas. JAMA Surg 2024; doi: 10.1001/jamasurg.2023.7010 10 Tjaden C et al.: Outcome and prognosis after pancreatectomy in patients with solid pseudopapillary neoplasms. Pancreatol 2019; 19: 699-709 11 Roesel R et al.: Minimally-invasive versus open pancreatic enucleation: systematic review and metanalysis of short-term outcomes. HPB 2023; 25: 603-13 12 Müller PC et al.: Robotic distal pancreatectomy: A novel standard of care? Benchmark values for surgical outcomes from 16 International Expert Centers. Ann Surg 2023; 278: 253-9 13 Marchegiani G et al.: IPMN involving the main pancreatic duct: biology, epidemiology, and long-term outcomes following resection. Ann Surg 2015; 261: 976-83
Das könnte Sie auch interessieren:
Neues aus der Gastroenterologie
Nicht jede Alkoholisierung ist auf Alkoholkonsum zurückzuführen. Beim sogenannten Eigenbrauer-Syndrom kommt es infolge pathologischer Auffälligkeiten des Darmmikrobioms zur endogenen ...
Zöliakie: Stand der Entwicklungpharmakologischer Therapieoptionen
Viele Patienten mit Zöliakie haben trotz glutenfreier Diät weiterhin Beschwerden. Zurzeit befinden sich einige innovative therapeutische Ansätze in Entwicklung: u.a. ein Inhibitor der ...
Das kardiovaskuläre Risiko von IBD-Patienten
Eine aktive IBD erhöht das Risiko für kardiovaskuläre Erkrankungen, während bestehende kardiovaskuläre Probleme die Wahl der Medikation erschweren. Das Ziel ist es, die richtige Balance ...