Update zum Thema entzündliche Hauterkrankungen
Autor:
Univ.-Prof. Dr. Paul Sator, MSc
Klinik Hietzing, Dermatologische Abteilung, Wien
E-Mail: paul.sator@gesundheitsverbund.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die aktuellen Studienergebnisse und Zulassungen decken ein breites therapeutisches Feld ab: Neuigkeiten gibt es etwa zur Antikörper-Behandlung der atopischen Dermatitis, die nun auch bei Kleinkindern ab sechs Monaten zugelassen ist, sowie hinsichtlich erster Systemtherapien beziehungsweise zielgerichteter Therapien bei Prurigo nodularis und der generalisierten pustulösen Psoriasis.
Atopische Dermatitis
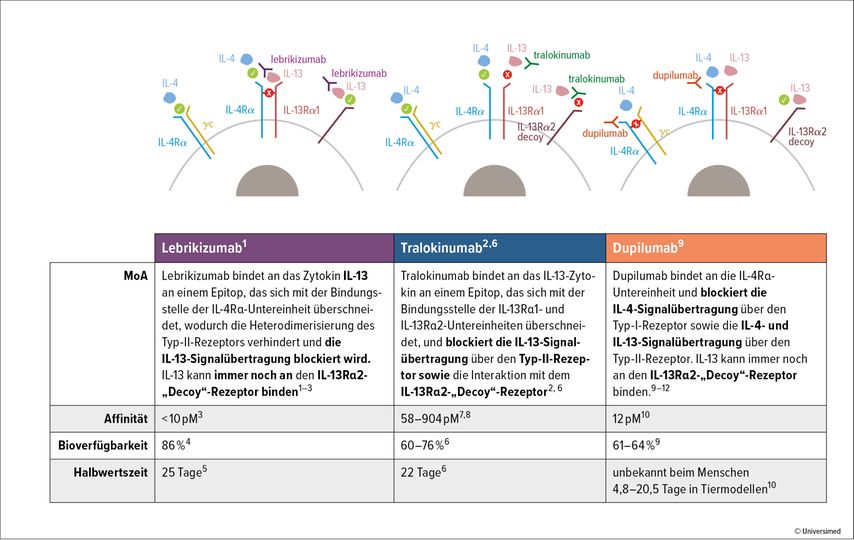
Der Anti-IL-4/-13-Antikörper Dupilumab erhielt bereits im September 2017 die EMA-Zulassung für Erwachsene mit atopischer Dermatitis (AD), 2019 folgte die Zulassung für Kinder ab zwölf Jahren, 2020 die für Kinder ab sechs Jahren. Neu ist seit März 2023 die Zulassung für Kleinkinder ab sechs Monaten. Die Erstattung ist in Österreich ab einem Alter von 12 Jahren möglich.
Dupilumab bei Kindern ab 6 Monaten
Basis der Anwendungsgebietserweiterungen war ein doppelblinder, placebokontrollierter Phase-III-Trial an Kindern zwischen sechs Monaten und sechs Jahren mit unkontrollierter AD (IGA≥3, EASI ≥16, durchschnittlicher Kratz-/Juckreiz NRS ≥4, Befall der Körperoberfläche [BSA] ≥10%).1 Sie erhielten entweder Dupilumab s.c. alle vier Wochen – je nach Körpergewicht dosiert: zwischen 5 und 15kg 200mg, zwischen 15 und 30kg 300mg – oder Placebo, jeweils plus topische Steroide (TCS). Als primärer Endpunkt war ein IGA 0/1 zu Woche 16 definiert, sekundär wurden der EASI-75 zu Woche 16 sowie Veränderungen in Juckreiz NRS und BSA evaluiert.
Signifikant mehr Kinder hatten nach 16-wöchiger Behandlung mit Dupilumab eine klare oder fast klare Haut (28% vs. 4%); bei jeweils 53% beziehungsweise 11% wurde ein EASI-75 festgestellt. Auch die sekundären Endpunkte wurden erreicht. Dupilumab war gut verträglich, die häufigsten therapieassoziierten unerwünschten Ereignisse (TEAE) waren Infektionen wie Nasopharyngitis, Infektionen der oberen Atemwege sowie Impetigo. Hautinfektionen (außer Herpes) waren unter Placebo + TCS doppelt so häufig wie unter Dupilumab, und alle schweren TEAE traten in der Placebo+TCS-Gruppe auf. Reaktionen an der Injektionsstelle sowie virale Herpesinfektionen waren in beiden Gruppen ähnlich (jeweils 2 bzw. 3% sowie 6 bzw. 5%).
Neuzulassung für Lebrikizumab
Ebenfalls bei AD wurde der hochselektive Anti-IL-13-Antikörper Lebrikizumab in den Studien ADvocate1 (n=283+141) und ADvocate2 (n=427)untersucht.2 Die Patient:innen mit moderater bis schwerer AD erhielten 2:1-randomisiert entweder Lebrikizumab 250mg (Sättigungsdosis 500mg zu Baseline und Woche 2) oder Placebo s.c., jeweils alle zwei Wochen. Beide Trials umfassten eine 16-wöchige Induktionsphase und eine 36-wöchige Erhaltungsphase: Nach 16 Wochen wurden Patient:innen mit Ansprechen (= IGA 0/1 mit einer Reduktion von ≥2 Punkten seit Baseline oder 75% Verbesserung im EASI Score) einer neuerlichen Randomisierung unterzogen und erhielten dann während der Erhaltungsphase entweder Lebrikizumab alle zwei Wochen (Q2W), alle vier Wochen (Q4W) oder Placebo (= Lebrikizumab-Absetzen).
Ein signifikant höherer Anteil der Verumgruppe erreichte den primären Effektivitätsparameter eines IGA 0/1 mit einer Reduktion von ≥2 Punkten seit Baseline, nämlich 43,1% vs. 12,7% (ADvocate1) beziehungsweise 33,2% vs. 10,8% (ADvocate2). Ähnlich die Ergebnisse der sekundären Endpunkte: Die Verringerung des Juckreiz-NRS um mindestens vier Punkte gegenüber dem Ausgangswert zu Woche 16 war unter Lebrikizumab signifikant höher, ebenso wie die Punktzahl auf der Schlafverlust-Skala um mindestens zwei Punkte gegenüber dem Ausgangswert. Auf Lebrikizumab Q4W randomisierte Patient:innen hatten zudem ein ähnlich dauerhaftes Ansprechen wie solche in der Lebrikizumab-Q2W-Gruppe; und ein relativ hoher Anteil derjenigen Patient:innen, die in der Erhaltungsphase Placebo erhalten hatten, sprachen 36 Wochen nach Absetzen des Medikaments weiterhin klinisch an.
Zu den Sicherheitsdaten: Die häufigste AE der Verumgruppe war eine mild bis mittelschwer ausgeprägte Konjunktivitis (7,4 vs. 2,8%). Die EMA hat Lebrikizumab im November 2023 für die Behandlung von Erwachsenen und Jugendlichen ab zwölf Jahren (Körpergewicht ≥40kg) mit mittelschwerer bis schwerer AD zugelassen.
Prurigo nodularis: Dupilumab als erste Systemtherapie
Ein ebenfalls spannendes Thema ist Prurigo nodularis (PN) und die bislang suboptimale therapeutische Situation: Aufgrund des relativen Mangels an zugelassenen Therapien wurden Betroffene häufig „off-label“ behandelt; gleichzeitig erlaubten viele Behandlungsoptionen eine lediglich eingeschränkte Kontrolle der PN-Symptomatik; systemische Immunmodulatoren einschließlich Methotrexat und Cyclosporin wiederum weisen zwar eine gewisse Wirksamkeit, aber auch ein schlechtes Sicherheitsprofil auf.3-6
2022 wurde die neue S2k-Leitlinie zur Diagnostik und Therapie des chronischen Pruritus veröffentlicht.7 Die topische Therapie der ersten Wahl sind demnach topische Steroide, in der Zweitlinie werden Pimecrolimus und Tacrolimus angegeben, während systemisch als Erstlinie die UV-Therapie, in der Zweitlinie Gabapentin und Pregabalin und als 3. Wahl Dupilumab empfohlen wird.
Zur Wirksamkeit und Sicherheit von Dupilumab bei erwachsenen PN-Patient:innen mit unzureichendem Ansprechen auf verschreibungspflichtige topische Therapien beziehungsweise bei Unverträglichkeit liegen die Ergebnisse der beiden Phase-III-Studien PRIME und PRIME2 vs. Placebo vor.8 Demnach wiesen signifikant mehr Patient:innen eine klare oder fast klare Haut unter Dupilumab auf (PRIME2 nach 12 Wochen: 45 vs. 16%, PRIME nach 24 Wochen: 48 vs. 18%), zudem war eine signifikante Verbesserung des Juckreizes bereits nach drei bis vier Wochen zu beobachten. Keine der TEAE (Kopfschmerzen, Hautinfektionen, Konjunktivitis) war schwerwiegend, alle Patient:innen erholten sich unter der entsprechenden Behandlung. NB: Da die Studiendaten zur 24-wöchigen Behandlung vorliegen, sollte eine Beendigung der Behandlung erwogen werden, wenn nach 24 Wochen kein Ansprechen zu erkennen ist.
Dupilumab ist in der EU seit Dezember 2022 als erste und bislang einzige Systemtherapie zur Behandlung der mittelschweren bis schweren PN bei Erwachsenen zugelassen, die für eine systemische Therapie in Betracht kommen.
Psoriasis: Hemmung von IL-36R und von TYK2
Die generalisierte pustulöse Psoriasis (GPP) ist definiert durch primäre, sterile, makroskopisch sichtbare Pusteln auf nichtakraler Haut, die mit oder ohne systemische Inflammation beziehungsweise mit oder ohne Plaque-Psoriasis auftreten können und entweder schubförmig (>1 Episode) oder persistent sind (>3 Monate).9 Die Prävalenz wird weltweit auf 1–9/1 Million geschätzt.10
Spesolimab ist ein monoklonaler IL-36R-Antikörper, der im Effisayil-1-Trial vs. Placebo an 53 GPP-Patient:innen untersucht wurde.11 Den primären Endpunkt der raschen pustulären Klärung zu Woche 1 erreichten 54% der Verumgruppe vs. 6% der Placebogruppe. Die Behandlung mit Spesolimab war zudem mit einem signifikanten Abfall von Markern der systemischen Entzündung assoziiert (Neutrophile, CRP). Spesolimab erhielt als erste zielgerichtete Therapie der GPP im Dezember 2022 von der EMA die Zulassung für die Behandlung von Erwachsenen.
Bei der Entwicklung der Psoriasis spielen auch weitere Entzündungspfade eine bedeutsame Rolle, unter anderem die IL-23/Il-17-Achse, die auch bei einer Reihe von Psoriasiskomorbiditäten involviert ist (u.a. psychiatrisch, kardiovaskulär, muskuloskelettal, gastrointestinal).12–14 Diese IL-23/IL-17-Achse wiederum wird vom TYK2-Signalpfad moduliert, als Teil eines Kinase-Paars mit JAK2.15,16
Deucravacitinib ist ein oraler, selektiver, kleinmolekularer allosterischer TYK-Inhibitor, der TYK2 in einem inaktiven Status hält und damit nachgeschaltete Zytokin-Signale verhindert.17,18 Zwei Phase-III-Studien (POETYK PSO-1 und -2) untersuchten Deucravacitinib an Patient:innen mit mittelschwerer bis schwerer Plaque-Psoriasis und nur unzureichendem Ansprechen auf den PDE-4-Hemmer Apremilast.19, 20 Die Randomisierung erfolgte 2:1:1 auf Deucravacitinib 6mg 1/d, Placebo oder Apremilast 2/d. Patient:innen, die unter Apremilast nach 24 Wochen PASI 50 beziehungsweise PASI 75 Non-Responder waren (PSO-1 bzw. PSO-2), wurden auf Deucravacitinib geswitcht. Nach 52 Wochen lag die PASI-75-Ansprechrate dieser Patient:innen bei jeweils 46,3% (PSO-1) beziehungsweise 42,3% (PSO-2).
Zur Sicherheit: Keine Trends waren für schwere zerebrokardiovaskuläre Ereignisse (MACE), schwere Infektionen oder Malignitäten zu beobachten, die Inzidenzen dieser AE waren unter Deucravacitinib relativ niedrig (<10%). Die EMA-Zulassung erfolgte im März 2023 für erwachsene Patient:innen mit mittelschwerer bis schwerer Plaque-Psoriasis, die für eine systemische Therapie infrage kommen; in Österreich wird der Wirkstoff seit 1. November 2023 erstattet.
Neue Daten zu Alopecia areata
Bei Alopecia areata (AA) kommt es zu einer Infiltration von hauptsächlich T-Zellen (nebst anderen Immunzellen) in und um den Haarfollikel, was einem Bienenschwarm ähnelt („swarm of bees around the follicle“).21 Zu den immunologischen Schlüsselfaktoren zählen CD8+ T-Zellen, IFN-γ und IL-15.22 Der Tyrosinkinasehemmer Baricitinib hat in der Immunologie bereits ein etabliertes Sicherheitsprofil und weist neben Zulassungen für die mittelschwere bis schwere AD und die rheumatoide Arthritis (RA) seit Juni 2022 auch die Zulassung für die Behandlung der schweren AA bei Erwachsenen auf.23
In den BRAVE-AA1- und -2-Studien erhielten 1200 Patient:innen mit schwerer AA randomisiert entweder Baricitinib (4 bzw. 2mg) oder Placebo.24 Das primäre Outcome eines SALT-Scores von ≤20 nach 36 Wochen (SALT = Severity of Alopecia Tool) erreichten 34% der 4mg- beziehungsweise 19,7% der 2mg-Gruppe.25Bei Verschlechterung des SALT-Scores um >20 Punkte wurde ein Wechsel von 2 auf 4mg Baricitinib eingeleitet, womit ein Großteil der Patient:innen wieder einen SALT-Score von ≤20 erreichte.26Eine durchgehend höhere Dosierung führte zu besseren Ergebnissen: Nach 104 Wochen zeigten 84,1% der anhaltend mit 4mg Baricitinib behandelten Patient:innen einen SALT-Score von ≤20, verglichen mit 52,4% bei Umstieg von 2 auf 4mg.26 Gegen die schwere AA ist außerdem der JAK3-Inhibitor Ritlecitinib bei Patient:innen ab zwölf Jahren seit Oktober 2023 zugelassen.
Vitiligo: Ruxolitinib-Creme effektiv
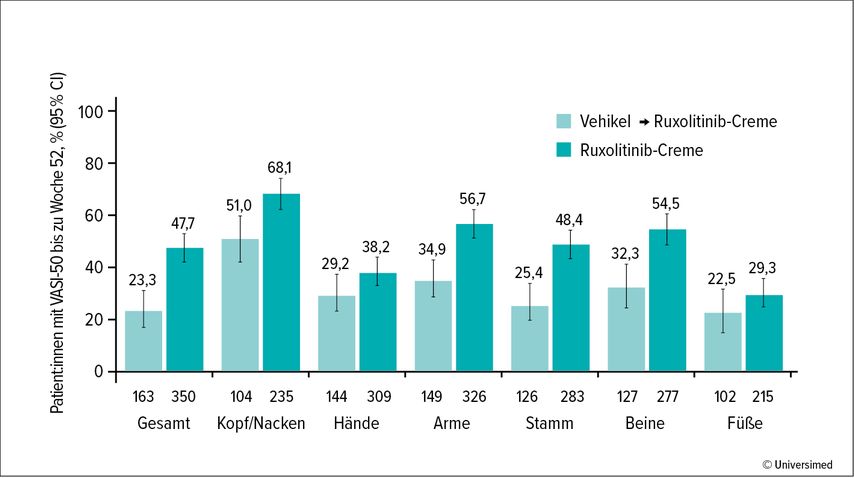
Der selektive und potente JAK1- und JAK2-Inhibitor Ruxolitinib wurde als Creme in zwei 52-wöchigen, Vehikel-kontrollierten Phase-III-Studien untersucht.27 Auf die 24-wöchige doppelblinde Behandlung folgte die Verlängerungsstudie, in der alle 300 Patient:innen Ruxolitinib-Creme einsetzten.
In beiden Studien erreichten signifikant mehr Patient:innen der Verumgruppe als mit Vehikel das Studienziel einer mehr als 50%igen, 75%igen beziehungsweise 90%igen Verbesserung des F-VASI („facial vitiligo area scoring index“).28 Die früh einsetzende (nach 12 Wochen), klinisch bedeutsame Repigmentierung nahm kontinuierlich bis Woche 52 zu; die Verbesserungen betrafen dabei auch kosmetisch sensible Bereiche wie Kopf/Nacken und Hände.28,29 Die häufigsten Nebenwirkungen waren Akne oder Pruritus an der Applikationsstelle. Alle Ereignisse waren gering- oder mittelgradig, und kein schwerwiegendes, während der Behandlung auftretendes unerwünschtes Ereignis wurde als behandlungsbedingt bewertet.27 Ruxolitinib-Creme erhielt im April 2023 die Zulassung für die nichtsegmentale Vitiligo mit Beteiligung des Gesichts bei Personen ab zwölf Jahren.
Hidradenitis suppurativa (HiS)
Für die mittelschwere bis schwere HiS erreichte der Anti-IL-17A-Antikörper Secukinumab in den kürzlich veröffentlichten SUNSHINE- und SUNRISE-Phase-III-Studien den primären Endpunkt des HiSCR („HS-clinical response“) und zeigte zudem anhaltende Wirksamkeit bis Woche 52.30Die Behandlung alle zwei Wochen beziehungsweise alle vier Wochen war bis Woche 52 gut verträglich; die häufigste Nebenwirkung waren Kopfschmerzen, neue Sicherheitssignale traten nicht auf. Secukinumab ist seit Mai 2023 für HiS von der EMA zugelassen.
Pathophysiologie
IL-4 und IL-13 können chronischen Juckreiz auslösen, indem sie das auf sensorischen Neuronen vorkommende IL-4α aktivieren und die TSLP-Expression fördern, was wiederum zur Aktivierung von pruritozeptiven Rezeptoren führt.31,32 IL-4 kann zudem sensibilisierend für andere Pruritogene wie IL-31 wirken und eine Hochregulierung von IL-31Rα vermitteln.31, 33 Die Schlüsselrolle von Typ-2-Zytokinen, einschließlich IL-4 und -13, in der Pathophysiologie von PN und Pruritus ist in Studien an Hautbiopsien, Zirkulationsspiegeln und Aktivierung von STAT6-Signalwegen in der Epidermis nachgewiesen.34-37
Label-Update für JAK-Inhibitoren (JAKi)
JAKi sollen nun bei Personen im Alter ≥65 Jahren, mit atherosklerotischen kardiovaskulären Vorerkrankungen beziehungsweise Risikofaktoren oder Risikofaktoren für Malignome nur dann zum Einsatz kommen, wenn keine geeigneten Behandlungsalternativen zur Verfügung stehen, beziehungsweise nur mit Vorsicht angewendet werden bei Vorliegen von Risikofaktoren für Lungenthrombose / venöse Thromboembolie. Neue Kontraindikationen wurden nicht angegeben, die therapeutischen Indikationen bleiben unverändert.38,23
Literatur:
1 Paller AS et al.: Lancet 2022;400:908-919 2 Silverberg JI et al.: NEJM 2023; 10.1056/NEJMoa 2206714 3 Kowalski EH et al.: Clin Cosmet Investig Dermatol 2019; 12:13-172 4 Elmariah S etal.: JAAD 2021; 84:747-760 5 Zeidler C et al.: Acta Derm Venereol 2018; 98:173-179 6 Qureshi AA et al.: JAAD 2019;80: 756-764 7 Ständer S et al.: https://register.awmf.org/assets/guidelines/013-048l_S2k_Diagnostik-Therapie-des-chronischen-Pruritus_2022-09.pdf (letzer Zugriff: 30. April 2024) 8 Yosipovitch G et al.: Presentation at AAD Annual Meeting, 25–29 June 2022, Boston 9 Navarini AA et al.: JEADV 2017;31: 1792-1799 10 ORPHA:247353: https://www.orpha.net/consor/cgi-bin/OC_Exp.php?lng=EN&Expert =247353 (letzter Zugriff: 30. April 2024) 11 Bachelez H et al.: NEJM 2021; 385:2431-40 12 Wu JJ et al.: J Eur Acad Dermatol Venereol 2022. doi: 10.1111/jdv.18044 13 Salas A et al.: Nat Rev Gastroenterol Hepatol 2020; 17: 323-337 14 Perez-Chada LM, Merola JF: Clin Immunol 2020; 214:108397 15 Harden JL et al.: J Autoimmun 2015; 64:66-73 16 Hawkes JE et al.: J Allergy Clin Immunol 2017; 140:645-653 17 Borzilleri RM et al.:Burger’s Medicinal Chemistry, Drug Discovery and Development; 8th ed. John Wiley & Sons; 2021 18 Tokarski JS et al.: J Biol Chem 2015;290:11061-11074 19 Armstrong AW et al.: AAD Meeting 2022, Boston, Poster Nr. 34658 20 Warren R et al.: Poster P465 EADV Spring 2022; ClinicalTrials.gov. NCT04036435 21 Olayinka JT and Richmond JM: Curr Res Immunol. 2021;2:7-11 22 Howell MDet al.: Front Immunol 2019;10:2342 23 Aktuelle Fachkurzinformation Olumiant 24 King B et al.: NEJM 2022;386: 1687-1699 25 Kwon O et al.: AAD 2022, Abstract L 26 King B et al.: AAD 2023, Poster 43046 27 ClinicalTrials.gov. NCT04052425, NCT04057573; Rosmarin D et al.: NEJM 2022; 387(16): 1445-1455 28 Rosmarin D et al.: EADV 2021; OP 2931 29 Passeron T et al.: EADV 2022, OP 3640 30 Kimball AB et al.: Lancet 2023, DOI: https://doi.org/10.1016/S0140-6736(23)00022-3 31 Oetjen LK et al.: Cell. 2017; 171(1):217-228 32 Wilson SR et al.: Cell. 2013 155(2): 285-295 33 Miake S et al.: Int J Mol Sci. 2019; 20(16):4053 34 Park K et al.: Eur J Dermatol. 201121:135-136 35 Parthasarathy V et al.: Preprint. https://doi.org/10.1101/2022.06.07.495051 Accessed June 2022 36 Fostini AC et al.: J Dermatolog Treat. 2013;24: 458-462 37 Fukushi S et al.: Br J Dermatol. 2011; 165:990-996 38 EMA confirms measures to minimise risk of serious side effects with Janus kinase inhibitors for chronic inflammatory disorders, Januar 2023: https://www.ema.europa.eu/en/documents/referral/janus-kinase-inhibitors-jaki-article20-procedure-ema-confirms-measures-minimise-risk-serious-side-effects-janus-kinase-inhibitors-chronic-inflammatory-disorders_en.pdf (letzter Zugriff: 30. April 2024) 39 Sator P: Neues bei entzündlichen Hauterkrankungen, DERM Aplrin-Kongress 2023, Salzburg
Das könnte Sie auch interessieren:
Gezielte Diagnostik, bessere Therapie: gründliche Anamnese als Grundlage
Was rät man Eltern von Neugeborenen, wie sie eine atopische Dermatitis (AD) bei ihrem Baby verhindern können? Wann macht eine komponentenbasierte Allergiediagnostik Sinn? Wie lassen sich ...
Komorbiditäten bei atopischer Dermatitis
Atopische Dermatitis (AD) ist häufig mit atopischen und nicht atopischen Komorbiditäten assoziiert. Das Auftreten von Begleiterkrankungen bzw. das Risiko dafür kann in vielerlei Hinsicht ...
Biologika-Therapie: Pipeline und Klinik
Biologika bieten die Option, in die hinter der atopischen Dermatitis stehenden Immunprozesse gezielt einzugreifen. Dieser Weg wurde zuerst mit dem Anti-IL-4/IL-13-Antikörper Dupilumab ...