Chancen und Grenzen der Immuntherapie bei Krebs
Bericht:
Dr. Corina Ringsell
Immuntherapien eröffnen neue Wege in der Behandlung von hämatologischen sowie soliden Tumoren und geben Hoffnung auf ein längeres Überleben bis hin zur möglichen Heilung der Betroffenen. Welche Möglichkeiten und Grenzen Immuntherapien haben, zeigten Expert:innen des CCC Vienna an einem spannenden Fortbildungsabend auf.
Immuntherapie bei gastrointestinalen Tumoren
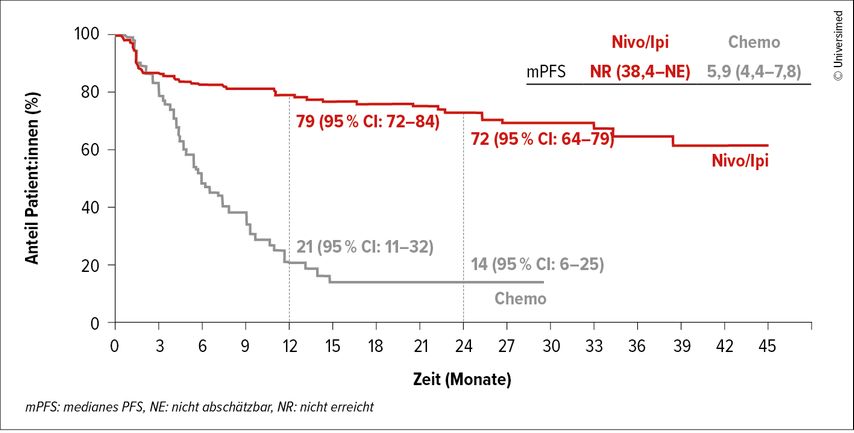
Den Stellenwert von Immuntherapien bei Tumoren des Magen-Darm-Trakts erläuterte Ap. Prof. PD DDr. Aysegül Ilhan-Mutlu, Universitätsklinik für Innere Medizin I, Klinische Abteilung für Onkologie, MedUni Wien/AKH Wien. Den Fokus legte sie dabei auf Tumoren mit hoher Mikrosatelliteninstabilität (MSI-high) bzw. Mismatch-Repair-Defizienz (dMMR), da betroffene Patient:innen aufgrund der hohen Antigenlast besonders von Immuntherapien profitieren. Dies zeigte die Referentin anhand mehrerer Studien. So verglich die Phase-III-Studie CheckMate 8HW Nivolumab plus Ipilimumab (Nivo/Ipi), Nivolumab-Monotherapie und eine Standardchemotherapie bei metastasiertem Kolorektalkarzinom. Ein primärer Endpunkt war das progressionsfreie Überleben (PFS) von Nivo/Ipi versus Chemotherapie in der Erstlinie.1 Abbildung 1 zeigt das mediane PFS, das im Nivo/Ipi-Arm ein Plateau über mehrere Jahre bildet. Hier stelle sich die Frage, ob für bestimmte Patientensubgruppen tatsächlich die Heilung eines metastasierten Kolorektalkarzinoms (st.p. mCRC) möglich sei, sagte Ilhan-Mutlu.
Abb. 1: PFS von Patient:innen mit zentral bestätigtem metastasiertem MSI-H- oder dMMR-Kolorektalkarzinom (modifiziert nach Andre T et al.)1
Dass bei resektablen GI-Tumoren die Heilungschancen durch eine alleinige Immuntherapie deutlich erhöht werden können, zeigte die Phase-II-Studie NICHE-2. Hier wurden nicht vorbehandelte Patient:innen mit nicht metastasiertem, lokal fortgeschrittenem dMMR-Kolorektalkarzinom neoadjuvant mit Nivo/Ipi behandelt. Nach nur zwei Gaben Nivo/Ipi zeigten rund 70% der Patient:innen eine komplette pathologische Remission (pCR). Bei bis zu 84 Monaten Nachbeobachtungszeit kam es zu keinen Rezidiven.2
Ein wichtiger Aspekt sei die Frage nach einer organerhaltenden Strategie, vor allem bei Rektumkarzinomen, sagte die Referentin. In einer kleinen Phase-II-Studie mit 41 Patient:innen mit Rektumkarzinom konnte gezeigt werden, dass die PD-1-Blockade mit Dostarlimab über sechs Monate bei allen zur kompletten klinischen Remission führte. Eine weitere Strahlentherapie, Chemotherapie oder chirurgische Resektion (derzeitiger Standard) waren nicht erforderlich.3
Etwa 10% der resektablen Magenkarzinome sind MSI-high. Die Studie GERCOR NEONIPIGA untersuchte bei resektablen MSI/dMMR-Magenkarzinomen die neoadjuvante Therapie mit Nivo/Ipi, gefolgt von radikaler Operation und adjuvanter Nivo-Gabe. Bei rund 60% der Patient:innen wurde intraoperativ eine pCR festgestellt.4 Ähnliche Ergebnisse erzielten die Studien DANTE/IKF-s633 und INFINITY.5,6 Ilhan-Mutlu erklärte, dass derzeit Studien untersuchen, ob die Magen-OP bei gutem Ansprechen auf die Immuntherapie entfallen kann.
Adoptive Zelltherapien: CAR-T-Zellen und TILs
Univ.-Prof. Dr. Antonia Müller, Universitätsklinik für Transfusionsmedizin und Zelltherapie, MedUni Wien/AKH Wien, gab einen Überblick über Arzneimittel für neuartige Therapien („advanced therapy medicinal products“, ATMP). Dabei handelt es sich um Arzneimittel für Menschen, die auf Genen, Geweben oder Zellen basieren. Sie werden in vier Kategorien unterteilt: Gentherapeutika, somatische Zelltherapeutika, biotechnologisch bearbeitete Gewebeprodukte und kombinierte ATMP.7 In Europa seien vor allem CAR-T-Zell-Produkte im Gebrauch, sagte Müller. Diese seien „lebendige Medikamente“, denn sie expandierten initial exponentiell und persistierten oft sehr lange, manchmal über Jahre, erklärte sie. Während der Expansionsphase könne es zu heftigen Reaktionen kommen, unter anderem zu neurologischen Ausfällen mit unspezifischen Symptomen wie Sprachstörungen und Zittern bis hin zu epileptischen Anfällen sowie zum gefürchteten Zytokin-Release-Syndrom (CRS). Daher gehöre die Therapie in erfahrene Hände, betonte sie.
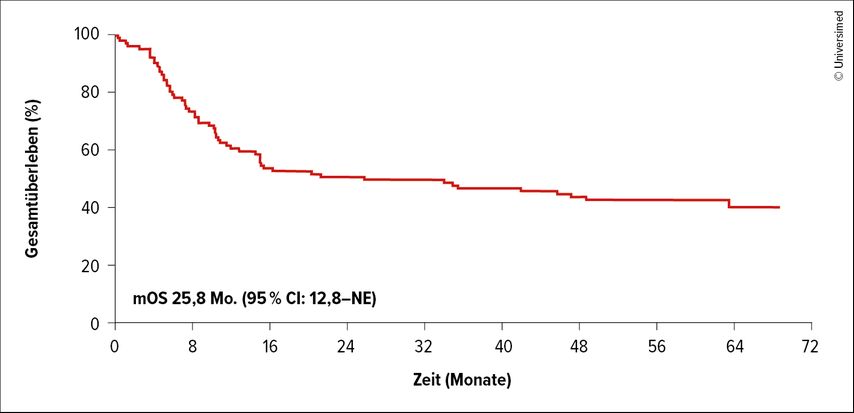
Derzeit werden CAR-T-Zellen vor allem bei hämatologischen Tumoren eingesetzt und erzielen dort hohe Gesamt- und Langzeitüberlebensraten. Zum Beispiel wurden die Ergebnisse der ZUMA-1-Studie mit Axicabtagen ciloleucel (Axi-cel) mit jenen der SCHOLAR-1-Studie (Chemotherapie) bei refraktärem großzelligem B-Zell-Lymphom verglichen.8 Das mediane Gesamtüberleben (mOS) lag in ZUMA-1 bei 31 Monaten und in SCHOLAR-1 bei 5,4 Monaten mit OS-Raten von 54% (ZUMA-1) und 20% (SCHOLAR-1). Inzwischen sind auch die 5-Jahres-Daten veröffentlicht. Die OS-Rate der Axi-cel-Gruppe betrug rund 43% (Abb.2), bei Patient:innen, die unter der Therapie eine Komplettremission (CR) erreicht hatten, lag die 5-Jahres-OS-Rate bei 64%.9
Abb. 2: Langzeitüberleben von Patient:innen mit refraktärem großzelligem B-Zell-Lymphom unter Axi-cel (modifiziert nach Neelapu SS et al.)9
Axi-cel ist auch in der Zweitlinie bei Rezidiven aggressiver B-Zell-Lymphome der Standardtherapie (SOC) überlegen, wie ZUMA-7 zeigt: Bei einem medianen Follow-up von 47 Monaten wurde das mOS in der Axi-cel-Gruppe nicht erreicht (vs. SOC 31 Mo.).10 Ähnlich vielversprechende Resultate erzielte Ciltacabtagen autoleucel (Cilta-cel) im Vergleich zu SOC bei Lenalidomid-refraktärem multiplem Myelom (MM).11 Allerdings könnten derzeit in der klinischen Praxis nur wenige Zielantigene angegriffen werden, sagte Müller. Dazu zähle unter anderem CD19. Bei den soliden Tumoren sei es noch schwieriger, da es hier nur wenige tumorexklusive Antigene gebe und diese auch nur schwach antigen seien, erklärte sie. Dies führe zu „Kollateralschäden“ aufgrund einer „On-target- – Off-tumor-Toxizität. Ein vielversprechendes Zielantigen sei GD2, allerdings lägen bislang nur sehr frühe Daten vor,12 so Müller.
Wenn keine Oberflächenantigene als Targets gefunden werden, sei eine T-Zell-Rezeptor-basierte Therapie eine Option, sagte die Referentin. Diese erreiche auch Ziele innerhalb der Zelle und sei zudem nicht so überstimuliert wie CAR-T-Zellen. Das bislang einzige und nur in den USA zur Behandlung von Synovialsarkomen zugelassene Produkt ist Afamitresgene autoleucel (Afami-cel). Es ist gegen das MAGE-A4-Antigen gerichtet. In der Zulassungsstudie SPEARHEAD-1 erzielte Afami-cel bei stark vorbehandelten Patient:innen mit Synovialsarkom eine Gesamtansprechrate (ORR) von 39%, wobei keine CR verzeichnet wurde, und ein mPFS von 3,8 Monaten.13 In den USA reichten diese Daten für eine Zulassung aus, so Müller. Man könne gespannt sein, ob die europäische Arzneimittelbehörde EMA eine Zulassung erteile. Und selbst dann, sei es eine Kostenfrage und werde zu großen Diskussionen führen, da eine Infusion rund 750000 Dollar koste.
Schließlich stellte die Referentin noch die tumorinfiltrierenden Lymphozyten (TIL) vor, die in den USA für die Melanomtherapie zugelassen sind. Dabei werden T-Lymphozyten aus dem Tumorgewebe entnommen, in vitro expandiert und aktiviert und anschließend wieder infundiert. Üblicherweise werde zusätzlich hoch dosiert Interleukin 2 verabreicht, was aufgrund der starken Nebenwirkungen für die Patient:innen sehr belastend sei, erklärte Müller. In der Zulassungsstudie für Lifileucel, das bislang einzige Produkt, erreichten 5% der Patient:innen eine CR und 26% eine PR; die PFS-Rate betrug rund 30% – bei starken Nebenwirkungen.14 Die EMA-Zulassung wird für dieses Jahr erwartet, doch auch hier stelle sich die Frage, ob die Daten gut genug sind, um eine Kostenübernahme (ca. $ 500000) zu rechtfertigen, so Müller.
Vakzine, onkolytische Viren, neue Checkpoints
Ao. Univ.-Prof. Dr. Christoph Höller, Universitätsklinik für Dermatologie, MedUni Wien/AKH Wien, spannte in seinem Vortrag einen Bogen von den Anfängen der Immuntherapie in der Onkologie bis hin zu möglichen neuen Therapieoptionen. Der Modelltumor für die Immuntherapie sei das maligne Melanom, da man schon lange gewusst habe, dass das Immunsystem bei dieser Entität eine große Rolle spielt, sagte er. So finde man histologisch sehr oft Makrophagen und Lymphozyten in den Präparaten. Bei bis zu 10% der metastasierten Melanome könne kein Primärtumor gefunden werden, von den Betroffenen erfahre man dann, dass viele Jahre zuvor ein Melanom diagnostiziert worden sei, das aber spontan verschwunden sei, erklärte Höller. Solche Patient:innen hätten bereits auf „alte“ zytokinbasierte Immuntherapien besser angesprochen als jene, bei denen der Primärtumor bekannt war, sagte er. Die mögliche Ursache sei, dass schon einmal eine Immunantwort ausgelöst wurde, die später mit zum Teil recht unspezifischen Maßnahmen reaktiviert werden konnte. Daher gebe es in der Dermatoonkologie eine lange Reihe von – oft erfolglosen – Versuchen einer Immuntherapie.
Der Durchbruch wurde mit der Entdeckung der Immuncheckpoints erzielt: Mit Einführung des CTLA4-Antikörpers Ipilimumab konnten etwa 20% Langzeitüberlebensraten bis zu zehn Jahren erreicht werden. Die nächste wichtige Entwicklung waren die PD-1-Antikörper wie Pembrolizumab (Pembro)und Nivolumab (Nivo). Zu diesen Immuncheckpoint-Inhibitoren liegen mittlerweile 10-Jahres-Daten vor.15,16 Die 10-Jahres-OS-Rate der mit Pembro behandelten Melanompatient:innen liegt bei rund 35%, unter Nivo (+Ipi) bei etwa 43%.15,16 Schaue man das melanomspezifische Überleben an, so seien die Raten noch höher, was bedeute, dass es inzwischen Patient:innen gibt, die nicht mehr am Melanom sterben, betonte Höller. Diese Erfolge werden jedoch mit immunbedingten Nebenwirkungen erkauft, die vor allem bei kombinierten Immuntherapien oft zum Therapieabbruch führen.
Der neueste Checkpoint-Inhibitor ist der LAG-3-Antikörper Relatlimab (RELA). In der RELATIVITY-047-Studie wurde er in Kombination mit Nivo gegen Nivo bei nicht vorbehandeltem metastasiertem oder nicht resezierbarem Melanom getestet.17 Die Kombination führte zu einem verlängerten mPFS (10,2 vs. 4,5 Mo.) und mOS (51 vs. 34 Mo.). Dabei kam es nur in 15% der Fälle zu einem Therapieabbruch aufgrund der Nebenwirkungen, was dem Bereich von Therapieabbrüchen unter Immunmonotherapien entspricht. In der Studie RELATIVITY-048 wurde zusätzlich noch Ipi in reduzierter Dosis hinzugegeben. Das Studienkollektiv war dabei nicht speziell ausgesucht, sondern bestand aus „All-comer“-Melanompatient:innen. Bei einer Nachbeobachtungszeit von mittlerweile vier Jahren beträgt das mPFS 52%, das mOS 72%, wobei es in rund 42% der Fälle zum Therapieabbruch aufgrund von Nebenwirkungen kam.18 Hier seien Untersuchungen zum Nebenwirkungsmanagement nötig, sagte Höller.
Er ging auch auf die adjuvante Therapie ein und zeigte Daten der Studie KEYNOTE-054 mit Pembro versus Placebo. In dieser Studie blieben rund 50% der Patient:innen langfristig tumorfrei.19 Das Problem sei, dass viele Patient:innen adjuvant behandelt werden, die auch ohne weitere Therapie gesund geblieben wären oder gar nicht von der Behandlung profitierten, so Höller.Daher werde nach Methoden gesucht, um die Therapie noch effektiver zu machen. Melanome haben eine hohe Mutationsrate, was das Entstehen von Tumor-Neoantigenen fördert. Dies ist die Grundlage für die Entwicklung von Tumorvakzinen, zum Beispiel auf Basis von mRNA.20 In der Phase-II-Studie KEYNOTE-942 verlängerte die adjuvante Behandlung mit mRNA-4157 plus Pembro bei reseziertem Hochrisiko-Melanom das rezidivfreie Überleben (RFS) im Vergleich zur Pembro-Mono mit RFS-Raten von 79% (vs. 62%).21 Die Phase-III-Studie sei fast abgeschlossen und man erwarte die Daten mit Spannung, so Höller.
Bei Patient:innen mit operablen Metastasen sei man inzwischen zur neoadjuvanten Therapie übergegangen, erklärte er. Die Immunantwort sei in diesem Setting noch stärker als bei der adjuvanten Behandlung und Studien hätten gezeigt, dass manche Patient:innen nach der Operation keine weitere Therapie benötigten.22,23
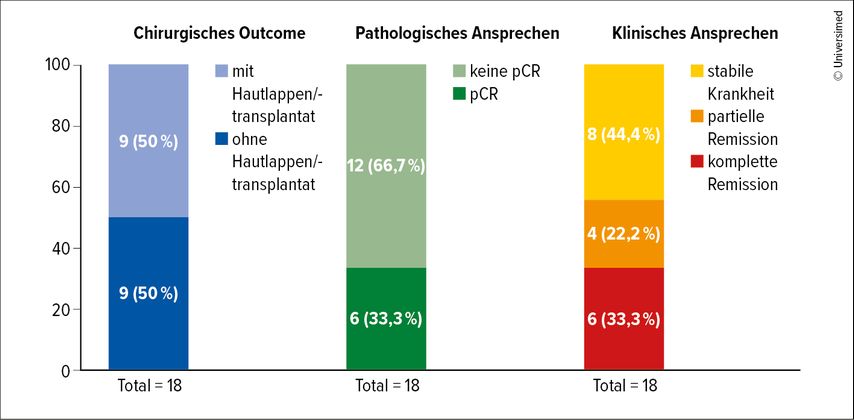
Schließlich zeigte der Referent noch Daten zu Talimogen laherparepvec (T-VEC), einem onkolytischen Virus, das direkt in die Metastasen injiziert wird und zu einer höheren lokalen Ansprechrate führt. Diese Therapie wurde in einer Studie unter Führung der Universitätsklinik für Dermatologie bei Patient:innen mit kutanen Basalzellkarzinomen eingesetzt. Die Tumoren waren zwar operabel, doch die Wiederherstellung hätte größere Eingriffe, etwa eine Lappenplastik, erfordert. Nach sechs Zyklen T-VEC konnte in 50% der Fälle der Tumor so verkleinert werden, dass nach der Operation ein einfacher Wundverschluss ausreichte. Ein Drittel der Patient:innen zeigte im OP-Präparat eine pCR und bei allen war der Tumor zumindest geschrumpft (Abb. 3).24 Hinsichtlich der translationalen Forschung habe diese Studie gezeigt, dass das Immunsystem „umprogrammiert“ werden kann, schloss Höller.
Abb. 3: Die Therapie mit dem onkolytischen Virus T-VEC verbessert bei operablen kutanen Basalzellkarzinomen das Outcome (modifiziert nach Ressler JM et al.)24
Literatur:
1 Andre T et al.: N Engl J Med 2024; 391(21): 2014-26 2 Chalabi M et al.: N Engl J Med 2024; 390(21): 1949-58 3 Cercek A et al.: J Clin Oncol 2024; 42(Suppl 17): Abstr. #LBA3512 4 André T et al.: J Clin Oncol 2022; 41(2): 255-65 5 Lorenzen S et al.: J Clin Oncol 2024; 42: 410-20 6 Raimondi A et al.: Ann Oncol 2025; 36(3): 285-96 7 www.pei.de/DE/arzneimittel/atmp/atmp-node.html 8 Neelapu SS et al.: Blood Adv 2021; 5(20): 4149-55 9 Neelapu SS et al.: Blood 2023; 141(19): 2307-15 10 Westin JR et al.: N Engl J Med 2023; 389(2): 148-57 11 San-Miguel J et al.: N Engl J Med 2023; 389(4): 335-47 12 Del Bufalo F et al.: N Engl J Med 2023; 388(14): 1284-95 13 D’Angelo SP et al.: Lancet 2024; 403(10435): 1460-71 14 Chesney J et al.: J Immunother Cancer 2022; 10(12): e005755 15 Robert C et al.: ESMO-Kongress 2024, Abstr. #LBA44; Ann Oncol 2024; 35 (Suppl 2): S1235 16 Larkin J et al.: ESMO-Kongress 2024, Abstr. #LBA43; Ann Oncol 2024; 35(Suppl 2): S1234-5 17 Tawbi HA et al.: J Clin Oncol 2024; 42(Suppl 16): Abstr. #9524 18 Ascierto PA et al.: J Clin Oncol 2024; 42(Suppl 16): Abstr. #9504 19 Versluis JM et al.: Nat Med 2020; 26(4): 475-84 20 Sahin U et al.: Nature 2017; 547(7662): 222-6 21 Weber JS et al.: Lancet 2024; 403(10427): 632-44 22 Blank CU et al.: N Engl J Med 2024; 391(18): 1696-708 23 Patel SP et al.: N Engl J Med 2023; 388(9): 813-23 24 Ressler JM et al.: Nat Cancer 2025; 6(1): 51-66
Das könnte Sie auch interessieren:
Die Rolle der Endothelzellen
Tim Dreier schloss sein Studium der Humanmedizin 2023 in Wien ab. Im Doktoratsstudium bei Ap.Prof. Priv.-Doz. Dr. Johanna Gebhart, PhD, forscht er an Endothelschäden bei leichten bis ...
Single-Port da Vinci – der nächste Entwicklungsschritt?
In den letzten zwei Jahrzehnten ist das Interesse an minimalinvasiven Techniken in der Urologie stark gestiegen und in vielen Bereichen „State of the Art“ geworden. Die neueste ...
EHA 2018 NEWSROOM CH
… Unser Universimed-Team ist für Sie in Stockholm! Die European Hematology Association (EHA) macht dieses Jahr von 14. bis 17. Juni in Stockholm Halt und versammelt Experten aus Europa ...