Neue Therapieoptionen bei DLBCL, M. Hodgkin, CML, AML und cGvHD
Autorin:
Prof. Dr. Annkristin Heine
Stellvertretende Klinikdirektorin der Med. Klinik III für Hämatologie, Onkologie, Rheumatologie und Stammzelltransplantation
Universitätsklinikum Bonn
E-Mail: annkristin.heine@ukbonn.de
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Auch das Jahr 2024 war in Hinblick auf die Einführung neuer Medikamente sowie „practice-changing“ Ergebnisse aus Grundlagenforschung und klinischen Studien spannend. Einige der gewonnenen Daten werden direkten Einzug in den klinischen Alltag und in entsprechende Leitlinien halten, andere werden in Zukunft neue Therapien bei Progress oder Resistenzentwicklung ermöglichen.
Rezidiviertes DLBCL: zeitlich begrenzte Kombinationstherapie
Für Patient:innen mit rezidiviertem diffusem großzelligem B-Non-Hodgkin-Lymphom (DLBCL), die nicht für eine Hochdosistherapie und autologe Stammzelltransplantation oder CAR-T-Zell-Therapie geeignet sind, stehen derzeit u.a. Polatuzumab-Rituximab-Bendamustin (Pola-BR), Tafasitamab-Lenalidomid oder konventionelle Immunchemotherapien zur Verfügung, die meist nur mit palliativer Intention verabreicht werden. Der bispezifische Antikörper Glofitamab ist für die Behandlung des rezidivierten oder refraktären DLBCL erst nach mindestens zwei Vortherapien zugelassen.
In der Plenary Session beim diesjährigen EHA-Kongress in Madrid wurde als „late-breaking abstract“ die StarGLO-Studie präsentiert.1,2 In dieser Phase-III-Studie wurden Patient:innen mit rezidiviertem oder refraktärem DLBCL, die für eine Transplantation nicht infrage kamen, 2:1 randomisiert. Es wurden ab der Zweitlinie acht Zyklen einer klassischen Immunchemotherapie bestehend aus Rituximab-Gemcitabin-Oxaliplatin (R-GemOX) mit acht Zyklen Glofitamab-GemOX verglichen, gefolgt von vier Zyklen einer Glofitamab-Monotherapie im experimentellen Arm.
Nach einem medianen Follow-up von 20,7 Monaten zeigte sich das mediane Gesamtüberleben (OS) im experimentellen Arm mit 25,5 Monaten signifikant länger als im Kontrollarm mit nur 12,9 Monaten (HR: 0,62). Das progressionsfreie Überleben (PFS) konnte von 3,6 auf 13,8 Monate verlängert und die Rate an kompletten Remissionen (CR) von 25,3% auf 58,8% erhöht werden.
Im Glofitamab-Arm trat häufiger ein Zytokinfreisetzungssyndrom (CRS) auf (44,2%), zumeist jedoch nur im ersten Zyklus und nur geringgradig. Im experimentellen Arm wurde über eine erhöhte Rate an Covid-19-Todesfällen (7 vs. 0), Infektionen und Neutropenien berichtet. Die Studie rekrutierte während der Covid-19-Pandemie, als wirksame antivirale Medikamente gegen Covid-19 noch nicht zugelassen waren. Nach entsprechender Zulassung und Protokollmodifikation traten keine Covid-19-assoziierten Todesfälle mehr auf. Dennoch wird allgemein nochmals auf die Notwendigkeit eines engmaschigen Monitorings und ggf. der Gabe von Immunglobulinen hingewiesen.
Insgesamt sind die Ergebnisse der ersten Kombinationstherapie aus einem bispezifischen Antikörper und einer Chemotherapie für das rezidivierte DLBCL beeindruckend und stellen für diese Patient:innengruppe in Zukunft eine attraktive Therapieoption dar.
Morbus Hodgkin: Checkpoint-Inhibition für alle in der Erstlinie?
Bereits in der Plenarsitzung des ASCO-Jahrestreffens 2023 in Chicago wurden die Ergebnisse der SWOG-S1826-Studie zum Vergleich von N-AVD (Nivolumab, Doxorubicin, Vinblastin, Dacarbazin) vs. Brentuximab-Vedotin(BV)-AVD (+ obligat G-CSF) für die Erstlinientherapie des M. Hodgkin im fortgeschrittenen Stadium vorgestellt und nun im Oktober 2024 im New England Journal of Medicine publiziert.3 Erstmalig wurden hier Erwachsene und Kinder ab einem Alter von zwölf Jahren in einer gemeinsamen Hodgkin-Studie eingeschlossen.
Nach einer Beobachtungszeit von im Median 2,1 Jahren fand sich eine 2-Jahres-PFS-Rate von 92% für N-AVD vs. 83% für BV-AVD. Neben der verbesserten Effizienz zeigten sich ein günstiges Sicherheitsprofil, insbesondere weniger Polyneuropathie, und weniger Therapieabbrüche im N-AVD-Arm.
Die Gesamtrate an Bestrahlungen nach Therapieende lag unter 1% und ist somit insbesondere für junge Patient:innen in Hinblick auf das Sekundärmalignomrisiko und Spättoxizitäten wie Herzinsuffizienz hochrelevant. Eine Subgruppenanalyse zeigte auch, dass insbesondere ältere Patient:innen über 60 Jahre (die in vielen Studien unterrepräsentiert sind) von der neuen Option profitieren und deutlich weniger Nebenwirkungen aufweisen, sodass N-AVD hier sicherlich für fitte alte Patient:innen eine attraktive neue Therapieoption darstellt.
Kritisch anzumerken ist, dass noch keine Langzeitdaten vorliegen und dass in den Studien SWOG S1826 und ECHELON-1 (BV-AVD vs. ABVD) alle Patient:innen fix mit sechs Zyklen behandelt wurden,3,4 wohingegen in der deutschen HD21-Studie (BrECADD vs. eBEACOPP für Patient:innen von 18–60 Jahren) die Mehrzahl der Patient:innen PET2-basiert nur vier Zyklen BreCADD erhielten.5
CML: Asciminib in Erstlinie – hohe Effizienz und gute Verträglichkeit
Im Gegensatz zu den Therapien bei aggressiven Lymphomen benötigen viele Patient:innen mit chronischer myeloischer Leukämie (CML) eine mehrjährige oder sogar lebenslange Therapie. Dementsprechend ist für diese Patient:innenklientel eine hohe Therapieeffizienz, aber auch eine gute Verträglichkeit hochrelevant.
Trotz hervorragender Ansprechraten bei den zugelassenen Tyrosinkinase-Inhibitoren (TKI) müssen zahlreiche Patient:innen im Laufe ihrer Erkrankung den TKI aufgrund von Resistenzentwicklungen oder Unverträglichkeiten wechseln oder unterbrechen.
Asciminib ist ein STAMP(„specifically targeting the ABL myristoyl pocket“)-Inhibitor, der sich durch seine spezifische Bindung an die Myristoyl-Tasche von den anderen zugelassenen TKI unterscheidet. In der Rezidivsituation ist Asciminib nach Gabe von mindestens zwei TKI bereits zugelassen. In der ASC4FIRST-Studie, die im April 2024 im New England Journal of Medicine publiziert wurde, fanden sich für unbehandelte CML-Patient:innen nach im Median nahezu 1,5 Jahren eine verbesserte Effizienz und ein günstiges Sicherheitsprofil (v.a. etwas weniger höhergradige Zytopenien) im Vergleich zu den Erst- und Zweitgenerations-TKI.6
48 Wochen nach Therapiebeginn hatten mehr Patient:innen unter Asciminib (MMR: 67,7% vs. 49% in der „investigator-selected“ TKI-Gruppe) ein molekulares Ansprechen erreicht. Das schnellere Ansprechen, gepaart mit der besseren Verträglichkeit und weniger notwendigen Dosisreduktionen, könnte sich in ein potenziell längeres Langzeitüberleben übersetzen.6 Langzeitdaten gilt es abzuwarten.
AML: Therapie-Erweiterung durch Menin-Inhibitoren
Das Behandlungsspektrum der akuten myeloischen Leukämie (AML) hat sich in den letzten Jahren nach Etablierung der demethylierenden Substanzen im klinischen Alltag durch die Einführung von zielgerichteten Therapien nochmals erweitert (u.a. Inhibitoren gegen BCL-2, FLT3, IDH1/2).
Zuletzt haben sich Menin-Inhibitoren in diese Erfolgsgeschichte eingereiht. Das Protein Menin wird durch das Tumorsuppressorgen MEN1 („multiple endocrine neoplasia gene 1“) kodiert und stellt einen essenziellen Kofaktor bei der Entstehung der KMT2A-rearrangierten Leukämie (KMT2Ar) dar.
Menin-Inhibitoren weisen antileukämische Aktivität in KMT2Ar- und NPM1-mutierter AML auf, führen zu einer Herunterregulation der MLL-Fusionsgene wie z.B. homeobox (HOX) und MEIS1 und induzieren die Reifung von leukämischen Blasten.
Der Menin-Inhibitor Revumenib wurde in einer Phase-I-Studie geprüft.7 Selbst schwer vorbehandelte Patient:innen oder Patient:innen nach allogener Stammzelltransplantation mit KMT2Ar- oder NPM1-mutierter AL zeigten eine Gesamtansprechrate von 53%. Insgesamt erfuhren 30% eine komplette Remission (CR) oder eine CR mit partieller hämatologischer Erholung (CRh), bei einer insgesamt guten Verträglichkeit.7
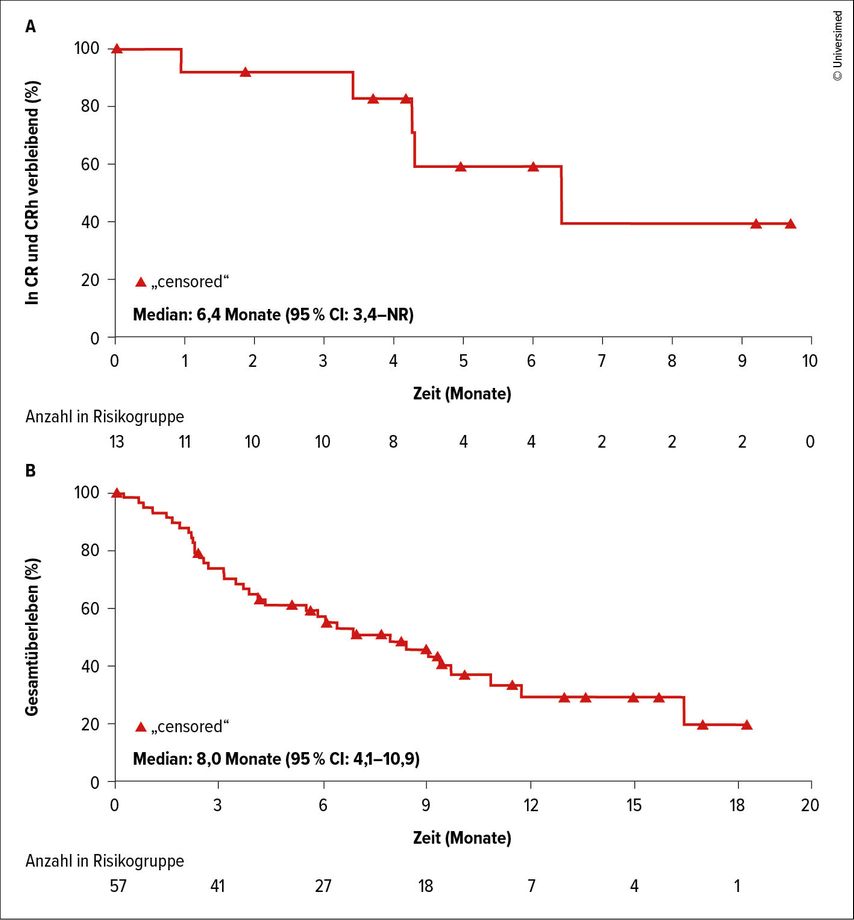
In der Phase-I/II-Expansionsstudie AUGMENT101 wurden bis Juli 2024 94 Patient:innen behandelt. Eine CR/CRh erreichten 23% der 57 hinsichtlich Effizienz evaluierbaren Individuen in der KMT2Ar-Population. Die mediane Dauer bis zum Erreichen einer CR/CRh betrug 1,9 Monate; diese hielten im Median 6,4 Monate an (Abb. 1). Ein Ansprechen in allen großen Subgruppen konnte verzeichnet werden.8
Abb. 1: Komplettremission (CR, mit partieller hämatologischer Erholung: CRh) und Gesamtüberleben in der Phase-I/II-Expansionsstudie AUGMENT101 (modifiziert nach Issa GC et al.)8
Neben Zytopenien können Long-QT-Syndrome und ein Differenzierungssyndrom auftreten. Revumenib wurde mittlerweile in den USA für die KMT2Ar-akute Leukämie zugelassen. Zwischenzeitlich wurden auch die Ergebnisse für die NPM1-mutierte Kohorte bekannt gegeben.
In Zukunft werden Studien zur Kombination von Menin-Inhibitoren mit Standard- oder Venetoclax-basierten Induktionstherapien oder anderen zielgerichteten Therapien von Interesse sein, auch um die Ansprechdauer nochmals zu verlängern.8
cGvHD: Kontrolle von Makrophagen als neues Therapieprinzip
Für die Behandlung der chronischen Steroid-refraktären Graft-versus-Host-Erkrankung (cGvHD) nach allogener Stammzelltransplantation gibt es keinen festen Standard. Für die cGvHD sind der BTK-Inhibitor Ibrutinib, der JAK1/2-Inhibitor Ruxolitinib und der ROCK2-Inhibitor Belumosudil von der FDA zugelassen.9
Der „cell surface colony-stimulating factor 1 receptor“ (CSF1R) wird insbesondere auf Monozyten und Makrophagen exprimiert, die zu Inflammation und Fibrose beitragen und somit einen essenziellen Treiber der cGvHD darstellen. Der Infiltrationsgrad an Makrophagen im Gewebe wird als prädiktiver Marker für die GvHD-Entwicklung betrachtet.10 Makrophagen präsentieren Selbst- und Alloantigene an T-Zellen und induzieren damit eine Immunantwort. Die Unterbrechung des CSF1R-CSF1-Signalwegs blockiert die Entwicklung von Monozyten zu Makrophagen und reduziert das Überleben von Makrophagen.
Die Phase-II-Studie AGAVE-201, die beim ASH-Jahrestreffen 2023 in der Plenarsitzung präsentiert und mittlerweile im New England Journal of Medicine veröffentlicht wurde, untersuchte den CSF1R-bindenden humanisierten IgG4-Antikörper Axatilimab bei Patient:innen mit rezidivierter oder refraktärer cGVHD nach mindestens zwei (im Median vier) Vortherapien in drei verschiedenen Dosierungen (0,3mg/1mg/3mg).11
Nach sechs Zyklen lag die Gesamtansprechrate (ORR) bei 74/67/50%, mit einem klinischen Ansprechen in den meisten beteiligten Organen, selbst bei ausgeprägter Fibrose. Das mediane „failure-free survival“ betrug 11,1 Monate. Das Ansprechen in allen drei Gruppen war mit <2 Monaten rasch und – wenn vorhanden – bei über der Hälfte der Patient:innen auch nach einem Jahr anhaltend. Interessanterweise zeigte sich das Ansprechen unabhängig von Schwere und Dauer der cGvHD, Anzahl der betroffenen Organe oder Versagen auf vorherige Therapien.
Typische Nebenwirkungen von Axatilimab waren eine transiente Laborwerterhöhung ohne konsekutiven Endorganschaden, bedingt durch die Depletion der Kupfferzellen, und periorbitale Ödeme. Infektionen traten bei ca. 70% der Patient:innen auf.
Somit wird mit Axatilimab eine neue Substanz zur Behandlung der refraktären cGvHD eingeführt, die aufgrund des neuen, nicht mit herkömmlichen Therapien überlappenden Wirkmechanismus auch ein interessanter Partner für Kombinationstherapien darstellen wird.12
Literatur:
1 Abramson JS et al.: EHA 2024, Abstr.: #LB3438 2 Abramson JS et al.: Glofitamab plus gemcitabine and oxaliplatin (GemOx) versus rituximab-GemOx for relapsed or refractory diffuse large B-cell lymphoma (STARGLO): a global phase 3, randomised, open-label trial. Lancet Lond Engl 2024; 404(10466): 1940-54 3 Herrera AF et al.: Nivolumab+AVD in advanced-stage classic Hodgkin’s lymphoma. N Engl J Med 2024; 391(15): 1379-89 4 Ansell SM et al.: Overall survival with brentuximab vedotin in stage III or IV Hodgkin’s lymphoma. N Engl J Med 2022; 387(4): 310-20 5 Borchmann P et al.: Assessing the efficacy and tolerability of PET-guided BrECADD versus eBEACOPP in advanced-stage, classical Hodgkin lymphoma (HD21): arandomised, multicentre, parallel, open-label, phase 3 trial. Lancet 2024; 404(10450): 341-52 6 Hochhaus A et al.: Asciminib in newly diagnosed chronic myeloid leukemia. N Engl J Med 2024; 391(10): 885-98 7 Issa GC et al.: The menin inhibitor revumenib in KMT2A-rearranged or NPM1-mutant leukaemia. Nature 2023; 615(7954): 920-4 8 Issa GC et al.: Menin inhibition with revumenib for KMT2A-rearranged relapsed or refractory acute leukemia (AUGMENT-101). J Clin Oncol 2025; 43(1): 75-84 9 Mohty M: CSF1R blockade for refractory chronic graft-versus-host disease. N Engl J Med 2024; 391(11): 1055-9 10 Kovalenko I et al.: Novel pharmacological treatment options of steroid-refractory graft-versus-host disease. Adv Hematol 2023; 2023: 9949961 11 Wolff D et al.: Axatilimab in recurrent or refractory chronic graft-versus-host disease. NEngl J Med 2024; 391(11): 1002-14 12 Sarantopoulos S: Targeting CSF1R in chronic GVHD – lessons in translation. N Engl J Med 2024; 391(11): 1053-5