Neues bei Kolorektal-, Magen- und Leberzellkarzinomen
Bericht:
Dr. rer. nat. Ine Schmale
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das ASCO Gastrointestinal Cancers Symposium (ASCO GI) wartete in diesem Jahr mit vielen richtungsweisenden Vorträgen zu kommenden innovativen Therapiestrategien für die Behandlung gastrointestinaler Tumoren auf. Für die Sitzungen mit oralen Vorträgen wurden allerdings hauptsächlich Studien mit etablierten immunonkologischen und zielgerichteten Substanzen ausgewählt, die derzeit den klinischen Alltag bestimmen.
Kolorektalkarzinom
Zielgerichtete Kombination plus Chemotherapie bei BRAF-Mutation
Bei etwa 8–12% der Betroffenen mit metastasiertem Kolorektalkarzinom (mCRC) werden BRAFV600E-Mutationen identifiziert. Die Kombination der zielgerichteten Substanzen Encorafenib+Cetuximab (EC) ist in Europa bereits ab der zweiten Therapielinie für Patient:innen mit BRAFV600E-mutiertem mCRC zugelassen. In der offenen, randomisierten Phase-III-Studie BREAKWATER wurde die zielgerichtete Therapiestrategie mit und ohne mFOLFOX6 bei unbehandelten Betroffenen untersucht.
Im Kontrollarm erhielten Patient:innen in der dreiarmigen Studie eine Standardtherapie (SOC) mit mFOLFOX6, FOLFOXIRI oder CAPOX mit oder ohne Bevacizumab. Die primären Endpunkte waren das progressionsfreie Überleben (PFS) und die Rate des objektiven Ansprechens (ORR) laut zentraler, unabhängiger Beurteilung. Beim ASCO GI wurden primäre Ergebnisse für den Vergleich der Studienarme EC+mFOLFOX6 vs. SOC präsentiert.1
Insgesamt 637 zuvor unbehandelte Patient:innen mit mCRC und BRAFV600E-Mutation wurden in die BREAKWATER-Studie eingeschlossen, 236 Erkrankte erhielten EC+mFOLFOX6, 243 SOC. Die Patient:innen waren median 61 Jahre alt, wiesen in 39% einen linksseitigen Primarius, in 61% der Fälle einen rechtsseitigen Primarius und in 62,6% der Fälle Lebermetastasen auf. Die mediane Dauer der Behandlung betrug 28,1 Wochen im EC-Arm vs. 20,4 Wochen im Kontrollarm. Mit einer medianen Nachbeobachtungszeit von zehn Monaten waren 58,1% vs. 33,7% der Patient:innen weiterhin unter der randomisierten Studienmedikation.
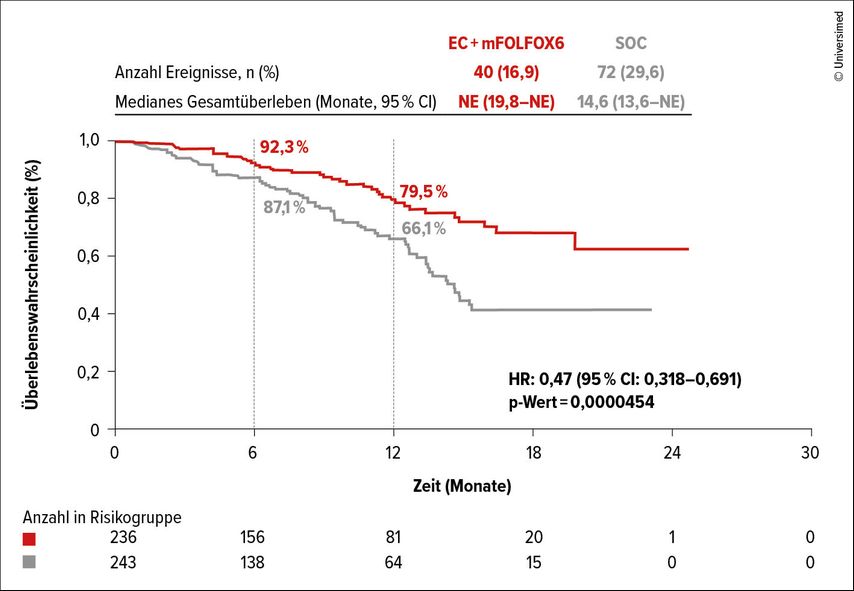
Es sprachen 60,9% vs. 40,0% der Patient:innen auf die Therapie an. Bei 68,7% vs. 34,1% der Erkrankten mit Ansprechen hielt die Remission ≥6 Monate an, bei 22,4% vs. 11,4% waren es ≥12 Monate. Der Median für das Gesamtüberleben (OS) war im experimentellen Arm noch nicht erreicht und lag im Kontrollarm bei 14,6 Monaten (Abb.1). Nach sechs Monaten lebten 92,3% vs. 87,1% und nach zwölf Monaten 79,5% vs. 66,1% der Patient:innen. Das Risiko zu sterben wurde mit der zielgerichteten Therapie um 53% gegenüber den Standardregimen signifikant reduziert (HR: 0,47; 95% CI: 0,32–0,69; p<0,0001).
Abb. 1: Gesamtüberleben (OS) unter Encorafenib+Cetuximab+Chemotherapie vs. Standardbehandlung (SOC) (modifiziert nach Kopetz S et al.)1
EC+mFOLFOX6 war insgesamt verträglich, ohne relevant häufigere Dosisreduktionen für die Chemotherapie oder Therapieabbrüche aufgrund von Nebenwirkungen im Vergleich zum Kontrollarm.
Die Kombination EC+mFOLFOX6 ist eine mögliche Therapieoption für Patient:innen mit BRAFV600E-mutiertem mCRC bereits ab der ersten Therapielinie, resümierten die Autor:innen.
Immuncheckpoint-Therapie bei mikrosatellitenstabilem mCRC
Für Patient:innen mit chemotherapierefraktärem, mikrosatellitenstabilem (MSS) mCRC gibt es nur wenige Therapiemöglichkeiten. Um dieser Klientel eine immunonkologische Therapie zu ermöglichen, wurde in einer Phase-II-Studie die Therapie mit Botensilimab, einem Fc-verbesserten CTLA-4-Inhibitor, und Balstilimab, einem mit bereits etablierten Substanzen vergleichbaren PD-1-Inhibitor, geprüft.2
Es wurden insgesamt 234 Betroffene mit nicht-MSI-H (mikrosatelliteninstabilen) oder nicht-dMMR (mismatchreparaturdefizienten) Tumoren ohne Lebermetastasierung, die bereits mit Fluoropyrimidin, Oxaliplatin und Irinotecan-haltiger Chemotherapie sowie optional einem Anti-VEGF- und/oder Anti-EGFR-Antikörper behandelt worden waren, eingeschlossen.
In fünf Studienarmen erhielten die Betroffenen randomisiert Botensilimab (75mg oder 150mg, q6w), jeweils mit oder ohne Balstilimab (240mg, q2w), sowie im Kontrollarm Trifluridin/Tipiracil oder Regorafenib. Das beste Nutzen-Risiko-Profil wurde mit 75mg Botensilimab+Balstilimab erreicht. 19% der Patient:innen zeigten unter dieser Kombination ein objektives Ansprechen und 55% eine Krankheitskontrolle gegenüber 0% bzw. 35% im Kontrollarm.
Mit der Kombination von Botensilimab und Balstilimab wurden bislang nicht beobachtete Remissionen bei Patient:innen mit chemorefraktären, mikrosatellitenstabilen mCRC erreicht, so die Autor:innen. Für die Phase-III-Studie wurde eine Dosierung von 75mg q6w für Botensilimab definiert.
Doppelte Checkpointblockade für MSI-H/dMMR Tumoren
Auch für Betroffene mit MSI-H und dMMR mCRC wurden erste Daten zu einer doppelten Immuntherapie mit Ipilimumab+Nivolumab beim ASCO GI präsentiert.3 Etwa 4–7% der mCRC-Erkrankten gehören in diese Patient:innengruppe. In der Studie CheckMate 8HW wurde die doppelte Checkpoint-Blockade vs. eine PD-1-gerichtete Monotherapie sowie vs. eine Chemotherapie geprüft.
Insgesamt 939 Patient:innen erhielten 2:2:1-randomisiert Nivolumab oder Nivolumab+Ipilimumab oder im Chemotherapiearm mFOLFOX6 oder FOLFIRI mit/ohne Bevacizumab oder Cetuximab (nach Wahl der Behandelnden) bis zum Tumorprogress. Die dualen primären Endpunkte waren das PFS laut zentraler Beurteilung im Vergleich von Nivolumab+Ipilimumab vs. Chemotherapie im Erstliniensetting sowie im Vergleich von Nivolumab+Ipilimumab vs. Nivolumab für alle Therapielinien. Beim ASCO GI wurden Ergebnisse für den Vergleich der Immun-Kombination vs. Immun-Monotherapie mit einer medianen Nachbeobachtungszeit von 47,0 Monaten gezeigt.
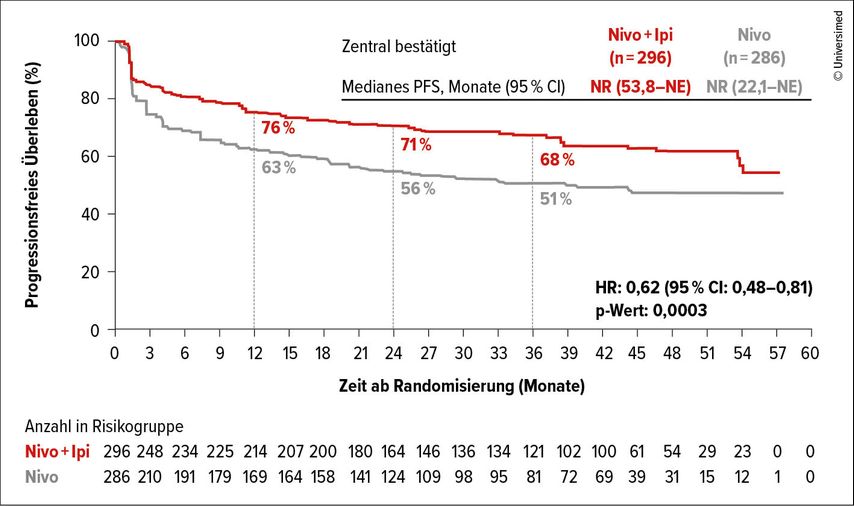
Die mediane Behandlungszeit mit Nivolumab+Ipilimumab betrug 20,5 Monate vs. 16,4 Monate mit Nivolumab-Monotherapie. Das PFS wurde durch die zusätzliche Ipilimumab-Gabe klinisch relevant und statistisch signifikant verlängert (HR: 0,62; 95% CI: 0,48–0,81; p=0,0003; Abb.2). Die PFS-Raten lagen bei 76% vs. 63% nach zwölf Monaten, 71% vs. 56% nach 24 Monaten und 68% vs. 51% nach 36 Monaten. Im Median lebten Patient:innen mit bestätigtem MSI-H/dMMR mCRC (81–84% aller randomisierten Erkrankten) im Nivolumab-Monotherapie-Arm 39,3 Monate progressionsfrei. Im Kombinationsarm wurde das mediane PFS noch nicht erreicht.
Abb. 2: Progressionsfreies Überleben (PFS) unter Nivolumab+Ipilimumab (Ipi) vs. Nivolumab(Nivo)-Monotherapie (modifiziert nach Andre T et al.)3
Die Ansprechrate betrug 71% vs. 58%, mit einem kompletten Ansprechen (CR) bei 30% vs. 28% der Patient:innen. Die mediane Zeit bis zu einem Ansprechen betrug 2,8 Monate in beiden Studienarmen, die mediane Dauer des Ansprechens (DOR) war in beiden Armen noch nicht erreicht.
Therapieassoziierte Nebenwirkungen Grad 3–4 wurden für 22% der Patient:innen unter Nivolumab+Ipilimumab und für 14% unter Nivolumab-Monotherapie berichtet. Es wurden keine neuen Sicherheitssignale beobachtet. Die krankheitsbedingte Lebensqualität verbesserte sich nach Therapiestart in beiden Studienarmen und erreichte eine klinisch relevante Verbesserung nach 21 Wochen.
Die Ergebnisse der Studie CheckMate 8HW etablieren Nivolumab+Ipilimumab als eine neue Standardtherapieoption für Patient:innen mit MSI-H/dMMR mCRC, erklärten die Autor:innen.
Magenkarzinom
Perioperative Therapie beim HER2-positiven Magenkarzinom
In einer dreiarmigen, offenen, randomisierten Phase-II-Studie wurde der Frage nach dem Nutzen einer HER2-gerichteten perioperativen Therapie beim HER2-positiven, resektablen Magenkarzinom (Stadium Ib–III) nachgegangen.
1:2:2-randomisiert erhielten insgesamt 172 Erkrankte eine neoadjuvante Chemotherapie, Trastuzumab+Chemotherapie oder Trastuzumab+Pertuzumab+Chemotherapie. Die Studie wurde 2015 mit Cisplatin+Fluoropyrimidin als Chemotherapie-Backbone begonnen und 2019, nach Veröffentlichung der FLOT-4-Ergebnisse in Europa, mit dem FLOT-Regime als möglichem Backbone erweitert.
Der primäre Studienendpunkt, ein höherer Anteil an gutem pathologischem Ansprechen (mpRR) mit entweder zusätzlichem Trastuzumab oder zusätzlichem Trastuzumab+Pertuzumab nach Abschluss der neoadjuvanten Phase, wurde nicht erreicht. Als sekundäre Endpunkte wurden u.a. das PFS und das OS untersucht und Ergebnisse beim diesjährigen ASCO GI mit einer medianen Nachbeobachtungszeit von 4,5 Jahren präsentiert.4
157 der Patient:innen konnten nach neoadjuvanter Therapie einer Resektion zugeführt werden, postoperativ wurden 118 Erkrankte behandelt. Ein PFS-Vorteil gegenüber der Chemotherapie wurde innerhalb der gesamten Studienpopulation mit einer 3-Jahres-Rate von 63,6% im Chemotherapiearm vs. 64,7% im Trastuzumab-Arm und 52,0% im Trastuzumab-Pertuzumab-Arm für keine der experimentellen Studienmedikationen nachgewiesen.
Nach der Erweiterung der Studie mit dem FLOT-Regime konnten insgesamt höhere 3-Jahres-PFS-Raten beobachtet werden (68,4% vs. 65,0% vs. 53,3%). Ein Unterschied für das OS in der gesamten Studienpopulation war ebenfalls nicht gegeben (3-Jahres-OS-Rate: 75,6% vs. 76,9% vs. 65,2%). Wurde ein mpRR unter jedweder Therapie erreicht, so waren das rezidivfreie Überleben (RFS) wie auch das OS signifikant verlängert. Das Risiko für einen Progress bzw. zu sterben war bei Patient:innen mit mpRR um 74% bzw. 75% gegenüber Patient:innen ohne mpRR reduziert (RFS: HR: 0,26; 95% CI: 0,13–0,53; p=0,0008; OS: HR: 0,25; 95% CI: 0,10–0,59; p=0,0041). Ein mpRR erreichten 23,3% der Patient:innen mit einer Chemotherapie vs. 37,0% der Patientinnen mit Chemotherapie+Trastuzumab vs. 26,4% mit Chemotherapie+Trastuzumab und Pertuzumab. Wurden FLOT oder FOLFOX/CAPOX als Chemotherapie-Backbone eingesetzt, lagen die mpRR bei 33,3% vs. 53,3% vs. 37,9%.
Die Toxizität werde unter der Kombination Chemotherapie+Trastuzumab und Pertuzumab erhöht, ohne dass dies einen Nutzen bringe, resümierten die Autor:innen. Der numerische Vorteil bei Zugabe von Trastuzumab zur Chemotherapie wurde mit der FLOT-Erweiterung nicht mehr gesehen. Auf Basis der höheren mpRR könne die Zugabe von Trastuzumab aber erwogen werden, wenn eine Tumorschrumpfung zur besseren kurativen Resektion notwendig sei.
Leberzellkarzinom
Die offene, randomisierte Phase-III-Studie CheckMate 9DW wurde durchgeführt, um die doppelte Immunblockade mit Nivolumab+Ipilimumab gegen Lenvatinib oder Sorafenib (nach Wahl der Behandelnden) bei der Therapie des nichtresezierbaren Leberzellkarzinoms (HCC) zu vergleichen.5
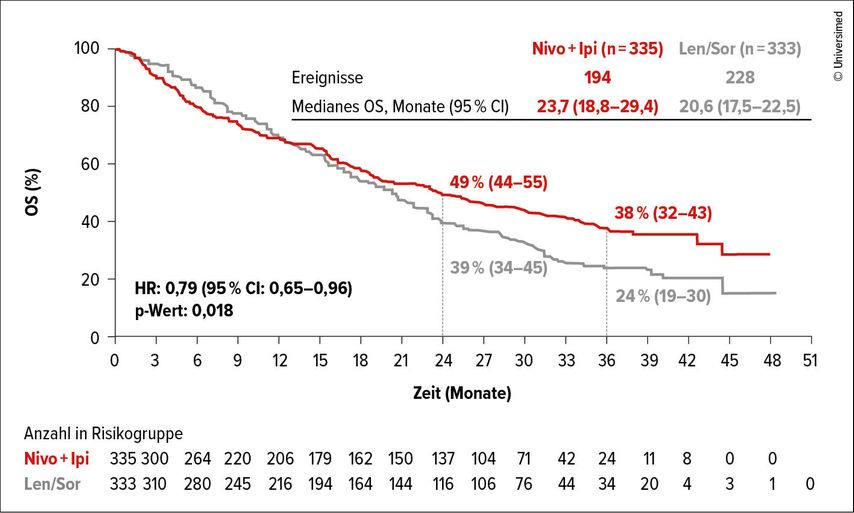
Insgesamt wurden 668 nicht vorbehandelte Patient:innen eingeschlossen, als primärer Studienendpunkt wurde das OS gewählt. Nach vier Zyklen der Kombinationstherapie wurde Nivolumab für maximal zwei Jahre und der Tyrosinkinase-Inhibitor bis Tumorprogress gegeben. Mit einer medianen Nachbeobachtungszeit von 35,2 Monaten lag das mediane OS bei 23,7 Monaten im Immuntherapie-Arm vs. 20,6 Monate im TKI-Arm.
Der Unterschied zwischen den Studienarmen war mit einer Hazard-Ratio von 0,79 und einem 95%-Konfidenzintervall von 0,65–0,96 statistisch signifikant (p=0,018). Die Kaplan-Meier-Kurven kreuzten sich nach ca. 15 Monaten, separierten dann spät mit einer 2-Jahres-OS-Rate von 49% vs. 39% und einer 3-Jahres-OS-Rate von 38% vs. 24% mit Vorteil für die Immuntherapie (Abb.3).
Abb. 3: Gesamtüberleben (OS) unter Nivolumab (Nivo) + Ipilimumab (Ipi) vs. Lenvatinib (Len) oder Sorafenib (Sora) (modifiziert nach Kudo M et al.)5
Es sprachen 36% vs. 13% der Erkrankten auf die Studienmedikation an, mit CR-Raten von 7% vs. 2%. Die mediane Zeit bis zum Ansprechen betrug 2,2 vs. 3,7 Monate, die mediane DOR 30,4 vs. 12,9 Monate. In beiden Studienarmen wurde ein signifikant längeres OS bei Betroffenen mit Ansprechen im Vergleich zu denen ohne Ansprechen beobachtet. Patient:innen mit stabiler Erkrankung lebten länger als Patient:innen mit Tumorprogress.
Die Ergebnisse der Studie CheckMate 9DW stützen Nivolumab+Ipilimumab als eine neue Erstlinientherapie für Patient:innen mit nichtresezierbarem Leberzellkarzinom, so das Fazit der Autor:innen.
Quelle:
ASCO Gastrointestinal Cancers Symposium (ASCO GI), 23.–25. Jänner 2025, San Francisco, USA
Literatur:
1 Kopetz S et al.: BREAKWATER: analysis of first-line encorafenib + cetuximab +chemotherapy in BRAF V600E-mutant metastatic colorectal cancer. ASCO GI 2025; Abstr. #16 2 Fakih MG et al.: Preliminary results from a randomized, open-label, phase 2 study of botensilimab with or without balstilimab in refractory microsatellite stable metastatic colorectal cancer with no liver metastases. ASCO GI 2025; Abstr. #23 3 Andre T et al.: First results of nivolumab + ipilimumab vs nivolumab monotherapy for microsatellite instability-high/mismatch repair-deficient metastatic colorectal cancer from CheckMate 8HW. ASCO GI 2025; Abstr. #LBA143 4 Wagner AD et al.: EORTC-1203-GITC “INNOVATION”: integration of trastuzumab, with or without pertuzumab, into perioperative chemotherapy of HER-2 positive stomach cancer: overall survival results. ASCO GI 2025; Abstr. #LBA331 5 Kudo M et al.: Nivolumab + ipilimumab vs lenvatinib or sorafenib as first-line therapy for unresectable hepatocellular carcinoma: CheckMate 9DW expanded analyses. ASCO GI 2025; Abstr. #520