Edaravone reduziert die Akkumulation von TDP-43 und modifiziert die pathologische Genexpression im ALS-Zellkulturmodell
Bericht: Dipl.-Ing. Dr. techn. Manuel Spalt-Zoidl
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der freie Radikalfänger Edaravone ist für die Behandlung der amyotrophen Lateralsklerose (ALS) zugelassen, wobei der genaue Wirkmechanismus bis dato nicht bekannt ist. Die folgende Arbeit von Mikuriya et al.1 liefert entscheidende neue Erkenntnisse zum möglichen Wirkmechanismus des Arzneimittels.
Die Pathogenese der ALS wird von einer Reihe genetischer, epigenetischer Faktoren und Umweltfaktoren beeinflusst. Besonders Genmutationen wie Superoxid-Dismutase 1 (SOD1), Chromosom-9-offener-Leserahmen-72 (C9orf72), TAR-DNA-bindendes-Protein (TARDBP) und Fused-in-Sarcoma (FUS) tragen wesentlich zur Entwicklung familiärer und sporadischer ALS bei. Für SOD1 und C9orf72 ist bekannt, dass sie an Stressreaktionen beteiligt sind, freie Radikale zerstören bzw. für Stressgranula essenziell sind.2,3TARDBP ist auch bekannt für seine Rolle bei der frontotemporalen Demenz (FTD), bei der das Protein TDP-43 akkumuliert.4 Für ALS wurden ähnliche Ablagerungen in den Motoneuronen beschrieben.5 Zudem ist das Gen ebenfalls für Stressgranula und die Homöostase der Mitochondrien relevant. FUS ist das jüngste bekannte Gen auf dieser Liste und führt ebenfalls zu pathologischen Ablagerungen in den Motoneuronen.6,7 Ob und inwiefern krankheitsmodifizierende Therapien für ALS diese pathologischen Prozesse beeinflussen, war bisher ungeklärt. Eine neue Studie des NeuroDiscovery Lab von Mitsubishi Tanabe Pharma in Cambridge/USA mit Daten aus Stammzellen, die aus dem Gewebe von ALS-Patient:innen gewonnen wurden, liefert hierzu neue Hinweise.
Antioxidative und antiinflammatorische Eigenschaften schützen Neuronen
Bei SOD1-positiven Patient:innen sind Zellen durch eine hohe Vulnerabilität gegenüber oxidativem Stress gekennzeichnet. Hier zeigt Edaravone signifikante Neuroprotektion durch antioxidative und antiinflammatorische Eigenschaften. Konkret reduziert der Radikalfänger reaktive Sauerstoffspezies (ROS), die Aktivierung von Mikroglia und Astrozyten sowie die Freisetzung proinflammatorischer Zytokine.
Auch in einer Patientin mit einer TARDBP-A382T-Mutation führte die Behandlung über 24 Stunden hinweg zu einer dosisabhängigen Erhaltung der Neuritstruktur und -länge in ALS-Zellen sowie zu einer damit einhergehenden Reduktion der Neurodegeneration. Interessanterweise wurde dieser Effekt mit dem wasserlöslichen Antioxidans Vitamin C nicht beobachtet. Die Autor:innen gehen daher davon aus, dass Edaravone zusätzliche Effekte auf die Zellen ausübt und damit die Neurodegeneration verhindert.
Edaravone korrigiert TDP-43-Fehlverlagerung
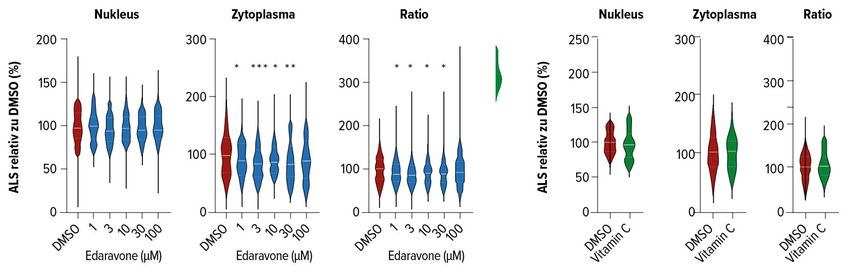
Ein wichtiges Kennzeichen in 97% der sporadischen ALS stellt die Fehlverlagerung des TAR-DNA-«binding» Proteins 43 (TDP-43) dar. Dieses wird bei der Erkrankung aus dem Nukleus in das Zytoplasma transportiert, erfährt dort pathologische posttranslationale Modifikationen und aggregiert zu unlöslichen, neurotoxischen Zelleinschlüssen.
Immunhistochemische Untersuchungen an Neuronen aus induzierten pluripotenten Stammzellen (iPSN) belegten, dass eine Behandlung mit Edaravone zu einer signifikanten Reduktion von TDP-43 im Zytoplasma und einer Normalisierung des entsprechenden Zytoplasma/Nukleus-Verhältnisses führte. Ein ähnlicher Effekt wurde bei Vitamin C nicht beobachtet, sodass dieser Mechanismus nicht über antioxidative Eigenschaften des Arzneimittels erklärt werden konnte (Abb. 1).
Abb. 1: Dosisabhängiger Effekt von Edaravone auf TDP-43-Fehlverlagerungen bei ALS (modifiziert nach Mikuriya et al.1)
Edaravone modifiziert Genexpression
Um die Mechanismen der Neuroprotektion und der Korrektur der TDP-43-Fehlverlagerung aufzuklären, führten Mikuriya et al.1 eine RNA-Sequenzierung durch, um die Genexpression vor und nach einer Edaravone-Behandlung zu evaluieren. Ein Vergleich mit historischen Genexpressionsmustern von ALS-Patient:innen lieferte dabei Hinweise, dass jene Gene, die in die oxidativen Stressantwort, den Wnt-Signalwegs, die posttranslationalen Modifikation und in das Ubiquitin-Proteasom-Systems involviert waren, am stärksten durch Edaravone beeinflusst wurden.
Interessanterweise werden diese Signalwege durch ein zentrales Gen namens X-Box-bindendes-Protein-1-Gen (XBP1) reguliert. Mikuriya et al.1 fanden in ALS-iPSN signifikant höhere Expressionen von XBP1 und seiner gespleissten Isoform (sXBP1) im Vergleich zu gesunden Zellen. Nach einer Behandlung mit dem Radikalfänger normalisierte sich die XBP1-Expression, jene der gespleissten Isoform jedoch nicht, sodass Edaravone seinen Effekt über Umwege auf XBP1 ausüben muss. Tatsächlich zeigte ein Quervergleich der Genexpressionsmuster, dass nur Sirtuin 1 (SIRT1) sowohl XBP1 als auch TDP-43 beeinflusst und wesentlich für die Deacetylierung und Deaktivierung von sXBP1 verantwortlich ist. Die Behandlung mit Edaravone führte zu einer signifikanten Hochregulierung von SIRT1 nach sechs Stunden und übt so einen Effekt auf die XBP1-Expression aus, schlossen die Autor:innen.
Fazit
Die Studie von Mikuriya et al.1 liefert erstmals Hinweise darauf, dass Edaravone über seine antioxidativen Eigenschaften hinaus gezielt in zentrale pathologische Mechanismen der ALS eingreift. Der Wirkstoff korrigiert die Fehlverlagerung von TDP-43 und moduliert krankheitsrelevante Genexpressionsmuster, insbesondere durch seinen Einfluss auf sXBP1 durch die Hochregulierung von SIRT1. Damit eröffnet sich ein neues Verständnis des neuroprotektiven Potenzials von Edaravone bei ALS.
Literatur:
1 Mikuriya S et al.: Edaravone mitigates TDP-43 mislocalization in human amyotrophic lateral sclerosis neurons with potential implication of the SIRT1-XBP1 pathway. Free Radic Biol Med 2025; 230: 283-93 2 Eleutherio ECA et al.: SOD1, more than just an antioxidant. Arch Biochem Biophys 2021; 697: 108701 3 Maharjan N et al.: C9ORF72 regulates stress granule formation and its deficiency impairs stress granule assembly, hypersensitizing cells to stress. Mol Neurobiol 2017; 54(4): 3062-77 4 Ho PC et al.: TDP-43 proteinopathy in frontotemporal lobar degeneration and amyotrophic lateral sclerosis: from pathomechanisms to therapeutic strategies. Ageing Res Rev 2024; 100: 102441 5 Rummers J et al.: TDP-43 seeding induces cytoplasmic aggregation heterogeneity and nuclear loss of function of TDP-43. Neuron 2025; 113(10): 1597-1613.e8 6 Kwiatkowski TJ et al.: Mutations in the FUS/TLS gene on chromosome 16 cause familial amyotrophic lateral sclerosis. Science 2009; 323(5918): 1205-8 7 Vance C et al.: Mutations in FUS, an RNA processing protein, cause familial amyotrophic lateral sclerosis type 6. Science 2009; 323(5918): 1208-11
Das könnte Sie auch interessieren:
Susanne Wegener: Reperfusionsversagen betrifft nicht nur Schlaganfall
Prof. Dr. med. Susanne Wegener ist leitende Ärztin an der Klinik für Neurologie des Universitätsspitals Zürich. Neben ihrer klinischen Arbeit ist sie stark in der Forschung tätig. Einer ...
Akut symptomatische Anfälle – sind sie alle gleich?
Epileptische Anfälle treten bei allen Personen mit Epilepsie auf, aber umgekehrt leidet nicht jede Person, bei der ein epileptischer Anfall auftritt, an Epilepsie. Tatsächlich handelt es ...
Management von Gliomen 2025
Trotz zahlreicher rezenter Erfolge in der Neurologie und Onkologie hält sich der Fortschritt in der Therapie von Gliomen zurück. Patient:innen mit Gliomen müssen immer noch mit einer ...