Aufeinandertreffen von Forschung und Praxis beim großzelligen B-Zell-Lymphom
Bericht:
Dr. Alexander Kretzschmar
Standen bei der letzten ICML 2023 noch die damals neuen CAR-T-Zell-Therapien im Vordergrund, waren es heuer vor allem Daten zur Therapie des großzelligen B-Zell-Lymphoms, die neue Erkenntnisse brachten.
Die auf der ICML 2025 vorgestellten Studien weisen darauf hin, dass sich die Therapie des rezidivierten/refraktären diffusen großzelligen B-Zell-Lymphoms (r/r DLBCL) im Umbruch befindet, wie Prof. Dr. Martin Dreyling, LMU München, in seinem resümierenden Vortrag feststellte – die alten Standards würden nicht mehr gelten oder werden zumindest herausgefordert. Die Kombination R-GemOx (Rituximab, Gemcitabin, Oxaliplatin) wird beim r/r DLBCL typischerweise in den Leitlinien in der Zweit- oder Drittlinientherapie empfohlen, insbesondere für Patient:innen, die für die autologe Stammzelltransplantation (ASZT) oder eine CAR-T-Zell-Therapie nicht geeignet sind, bzw. für ältere oder gebrechliche Patient:innen mit eingeschränkter Organfunktion. Die in Lugano präsentierten Daten zeigen jetzt für R-GemOx gleich mehrere Kombinationen als überlegene Alternative und Anwärter auf den Status als Standardtherapie.
r/r DLBCL – neue Alternativen zuR-GemOx
In der rezidivierten Situation zeigt die POLARGO-Studie eine signifikant verbesserte Wirksamkeit durch die Hinzunahme von Polatuzumab Vedotin zu R-GemOx. Dadurch konnte die Gesamtansprechrate (ORR) um rund 30% und die Rate der Komplettremissionen (CR) um 20% erhöht werden. Dies resultierte in einem um 20% verlängerten progressionsfreien Überleben (PFS), das Gesamtüberleben (OS) wurde um rund 10% verlängert.1 R-GemOx ist damit beim r/r DLBCL kein Therapiestandard mehr, konstatierte Dreyling.
Die auf der ICML präsentierten 2-Jahres-Follow-up-Daten der STARGLO-Studie (n=274) zeigen auch für die Kombination Glofitamab plus Gemcitabin und Oxaliplatin (Glofit-GemOx; n=183) eine anhaltende Überlegenheit gegenüber R-GemOx (n=91) mit einer frühen und tiefen molekularen Response. 62,8% der Patient:innen (median 69 Jahre, davon 62,5% ≥65 Jahre; 53% Männer) hatten 1 Vortherapie, 60,6% waren refraktär gegenüber der letzten Therapie. Nach einem Follow-up von 24,7 Monaten war das mediane OS unter Glofit-GemOx weiterhin signifikant länger (nicht erreicht vs. 13,5 Monate; HR: 0,60; 95%-KI: 0,42–0,85; p=0,003). Die 24-Monats-OS-Rate betrug 54,4% vs. 33,6% unter R-GemOx. Auch das mediane PFS war mit 13,8 vs. 3,6 Monate signifikant länger (p<0,001). Die ORR (68,3% vs. 40,7%) und die CR-Rate (58,5 vs. 25,3%) waren ebenfalls signifikant höher. In einer Landmark-Analyse betrug die OS-Rate 1 Jahr nach Therapieende unter Glofit-GemOx 89,3% und die PFS-Rate 82,4%. Zytokinfreisetzungssyndrome (CRS) aller Grade traten bei 44% der Glofit-Population auf (Grad 3: 2,3%). Es gab 4 Fälle eines Immuneffektorzell-assoziierten Neurotoxizitätssyndroms (ICANS), meist Grad 1–2, alle gleichzeitig mit CRS.2
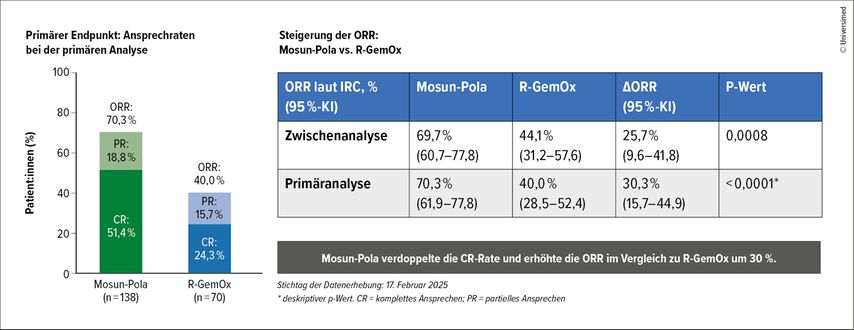
Schließlich präsentierte Prof. Jason Westin, Houston, USA, in der Late-Breaking-Abstracts-Session mit der Kombination des bispezifischen Antikörpers Mosunetuzumab und des Antikörper-Wirkstoff-Konjugats (ADC) Polatuzumab Vedotin einen dritten potenziellen Therapiestandard. In der SUNMO-Studie wurde die ORR (primärer Endpunkt) bei 208 Transplantationsungeeigneten r/r LBCL-Patient:innen von Mosunetuzumab plus Polatuzumab in der Primäranalyse mit 70,3% vs. 40,0% unter R-GemOx signifikant erhöht (HR: 0,41; 95%-KI: 0,28–0,61; p<0,0001) und die CR-Rate verdoppelt (51,4% vs. 24,3%). Der PFS-Vorteil (11,5 vs. 3,8 Monate; p<0,0001) war konsistent über alle Subgruppen, darunter primär refraktäre Patient:innen, die Anzahl der Vorbehandlungen sowie bei Hochrisikopatient:innen. Das 12-Monats-OS zeigt in einer Interimsanalyse mit 61,4 vs. 53,4% eine numerische Überlegenheit.3
Abb. 1: Mosun-Pola erhöhte die Gesamtansprechrate signifikant im Vergleich zu R-GemOx (modifiziert nach Westin J et al.)3
Dreyling begrüßte die neuen Studiendaten: „Es ist immer besser, mehrere Optionen als nur eine Option mit einer Chemotherapie zu haben, die nicht besonders gut läuft.“
Er erwartet jetzt auch für R-CHOP in der Erstlinientherapie eine Aktualisierung, etwa mit Mosunetuzumab plus Polatuzumab oder R-Pola-Glo, so Dreyling. Dr. Rebecca Wurm-Kuczera, Charité – Universitätsmedizin Berlin, präsentierte hierzu die prospektive Phase-II-Studie zu R-Pola-Glo zur Chemotherapie-leichten Kombination von Rituximab plus Polatuzumab Vedotin und Glofitamab (EudraCT 2022 003398 51; NCT05798156) bei zuvor unbehandelten Patienten mit aggressivem B-Zell-Lymphom >60 Jahre, die für eine voll dosierte R-CHOP-Kombi nicht infrage kommen. Die einarmige Studie wird derzeit in Österreich und Deutschland durchgeführt. Vorgestellt wurden nur die Ergebnisse der initialen Kohorte von 80 Patient:innen (51,3% Männer; median 80 Jahre; 33% mit IPI 3, 32,5% mit IPI 4–5; 42,5% im Stadium IV). Sie entspricht sehr gut der Population, wie man sie im Klinikalltag findet, so die Onkologin.
Zur PFS-Rate nach 12 Monaten als primärem Endpunkt sind die Daten noch nicht reif. Die ORR der initialen Kohorte in den Zyklen 2 bzw. 6 bzw. nach Ende der Behandlung betrugen 92,5% (CR: 55%), 92,5% (CR: 73,8%) bzw. 90% (CR: 81,2%). Nach Therapieende lag die Rate metabolischer Komplettremissionen bei 82%; 90% der Patient:innen waren noch am Leben. R-Pola-Glo zeigte ein sehr gutes Sicherheitsprofil und hohe Ansprechquoten. CRS traten in 21% der Fälle auf, vor allem im 1. Zyklus. Nur 2,5% waren ≥Grad3. ICANS traten bei 4% der Patient:innen auf. 3 Patient:innen verstarben aufgrund von Infektionen.
Fazit Wurm-Kuczera: Die Chemotherapie-leichte Kombination ist ein potenziell wirkungsvoller Behandlungsansatz für Patient:innen, die keine Standard-Chemotherapie vertragen.4
Therapie älterer, gebrechlicher DLBCL-Patient:innen
R-mini-CHOP ist gegenwärtig die Standardtherapie für ältere, gebrechliche therapienaive DLBCL-Patient:innen. Allerdings sind viele Betroffene aufgrund von Komorbiditäten oder hohem Alter nicht geeignet für Anthrazyklin-basierte Therapien. Auf der ICML wurden mehrere Alternativen vorgestellt, darunter als chemotherapiefreie Option der CD3xCD20-bispezifische Antikörper Epcoritamab. Er ist in der EU derzeit nur zur Therapie des r/r DLBCL und des rezidivierten/refraktären follikulären Lymphoms (r/r FL) nach zwei vergeblichen Vortherapien zugelassen. Dr. David Belada, Lékarská fakulta v Hradci Králové, stellte die Ergebnisse des Epcoritamab-Monotherapie-Armes (n=45) der Phase-II-Studie EPCORE DLBCL-3 (NCT05660967) bei älteren Patient:innen und Komorbiditäten bei neu diagnostiziertem DLBCL vor.
82% der Patient:innen waren ≥80 Jahre (38% ≥85 Jahre), 60% waren Frauen, mit einem IPI-Score 1–2 (42%) bzw. 3–5 (58%) sowie einem ECOG PS 0–1 (76%) bzw. 2 (24%); 87% hatten kardiovaskuläre Risikofaktoren, 40% weitere Komorbiditäten. Die Monotherapie mit Epcoritamab erzielte eine hohe ORR (n=40) von 78%, davon in 70% eine Komplettremission (CR) und in 8% eine partielle Response (PR). 14 von 15 ausgewerteten Respondern waren MRD-negativ. Die mediane Dauer der Response (DOR) betrug 6,4 Monate, die mediane Dauer der CR (DOCR) 5,4 Monate. Das mediane PFS betrug 8,1 Monate, das mediane Gesamtüberleben (OS) 9,5 Monate.
Epcoritamab war laut Belada insgesamt gut verträglich. Jedoch traten mehr neurologische therapiebezogene unerwünschte Ereignisse (TEAE) auf als erwartet: 71% der Patient:innen erlitten ein CRS (Grad 1: 39%; Grad 2 27%; Grad 3: 5%). 16% erlitten ICANS, die sich alle zurückbildeten. 18% hatten schwere Infektionen, in 9% der Fälle traten Neutropenien, aber keine febrilen Neutropenien, auf. 18% beendeten die Studie wegen TEAE. 5 Patient:innen verstarben aufgrund von TEAE (n=2: Covid-19; je n=1: CMV-Reaktivierung, Tumorlysesyndrom, Tumorhämorrhagie).
Insgesamt ist Epcoritamab für Belada eine gute Therapieoption auch bei sehr alten nicht vorbehandelten DLBCL-Patient:innen. Zugunsten einer optimierten Verträglichkeit empfahl er eine genaue Vorselektion geeigneter Patient:innen.5
Follikuläres Lymphom
Beim FL gibt es eine Verlagerung hin zu Chemotherapie-freien Ansätzen. Die bei der ICML 2025 gezeigten Daten bestätigen diesen Trend bei zuvor nicht behandelten Patient:innen und auch in der rezidivierten/refraktären Situation. In der Erstlinie wurden für das verlängerte Follow-up in der MITHIC-FL1-Studie für die Monotherapie mit Mosunetuzumab s.c. 76 Patient:innen (median 59 Jahre; 56 Männer; 79% ECOG 0) ausgewertet. 19% waren im Stadium 3A, 74% im Stadium IV und 40% mit einer Tumormasse ≥7cm, wobei auch eine Chemotherapie infrage käme. Bereits bekannt sind die ORR (95%) und die CR (82%). Erstmals gezeigt wurde jetzt nach einem Follow-up von 16,7 Monaten die PFS-Rate von 89,3% nach 12 Monaten. 13 Patient:innen hatten einen Progress (PD), 7 Patient:innen eine stabile Erkrankung (SD). 4 Patient:innen erhielten wegen einer Transformation R-CHOP.6
„Practice changing“ in der Zweitlinie
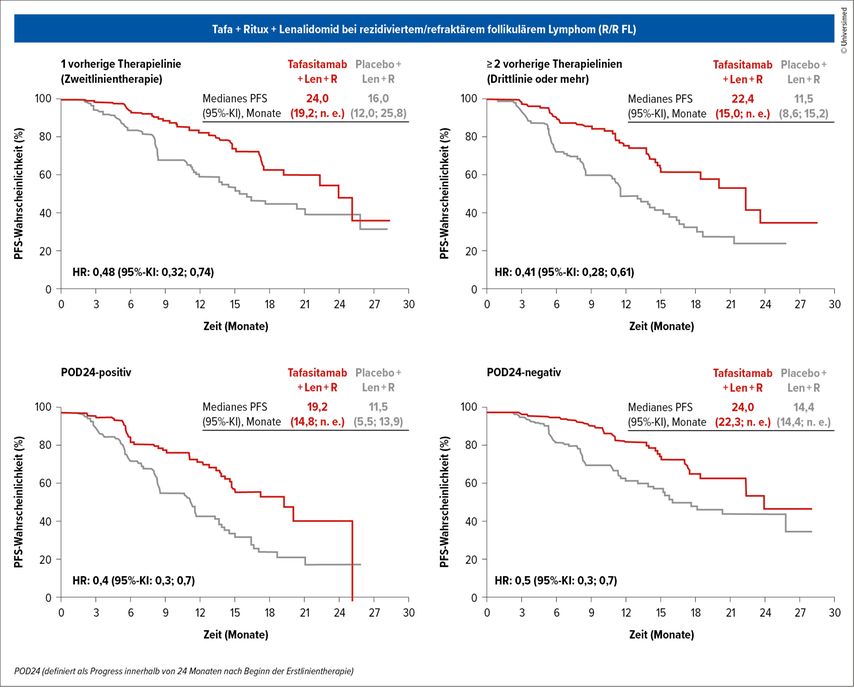
In der Zweitlinie liefert die inMIND-Studie neue Erkenntnisse, welche die Behandlung des r/r FL nach allgemeiner Erwartung verändern werden. An der Phase-III-Studie nahmen 548 Patient:innen mit r/r FL teil (median 64 Jahre, 20% ≥75 Jahre; Grad 1–3A; ECOG PS 0–2; ≥1 Vortherapie). Sie erhielten entweder den CD19-Antikörper Tafasitamab plus Lenalidomid plus Rituximab (Tafa+R2) oder Placebo plus Lenalidomid plus Rituximab (R2). Bereits präsentiert wurden das PFS (primärer Endpunkt: 22,4 vs. 13,9 Monate; p<0,0001) und die Zeit bis zur nächsten Therapie (TTNT: nicht erreicht vs. 28,8 Monate; p<0,0001). Studienleiterin Prof. Laurie Sehn, University of British Columbia, Vancouver, stellte in Lugano eine präspezifizierte Subgruppenanalyse vor.
Nach der neuen POD24-Definition (Rezidiv nach Beginn der letzten Therapie) waren 45% der Patient:innen POD24-positiv.
-
POD24-positiv: medianes PFS 19,2 vs. 11,5 Monate; HR: 0,4 (95%-KI: 0,3–0,7)
-
POD24-negativ: medianes PFS 24,0 vs. 14,4 Monate; HR: 0,5 (95%-KI: 0,3–0,7), refraktär gegenüber vorheriger Anti-CD20-Therapie
-
Tafasitamab zeigte dabei eine überlegene Wirksamkeit trotz vorheriger Therapieresistenz.
Auch stark vortherapierte Patient:innen profitieren demnach von der Therapie:
-
1 Vortherapie: 24,0 Monate (19,2 – nicht erreicht) vs. 16,0 Monate (12,0–25,8); HR: 0,48 (95%-KI: 0,32–0,74)
-
≥2 Vortherapien: 22,4 Monate (15,0 – nicht erreicht) vs. 11,5 Monate (8,6–15,2); HR: 0,41 (95%-KI: 0,28–0,61)
Histologische Transformationen traten im experimentellen Arm nicht auf, im Vergleichsarm traten 9 auf. Bezüglich CD19-Expression bei Therapieende gab es keine Hinweise für einen CD19-Verlust nach der Therapie mit Tafasitamab.
Die Kombination Tafasitamab plus Lenalidomid plus Rituximab bewirkt demzufolge eine signifikante Verlängerung des PFS, erhöhte Ansprechraten und konsistente Vorteile in allen Subgruppen (POD24, refraktär gegenüber vorheriger Anti-CD20-Therapie, Anzahl vorheriger Therapielinien und FLIPI-Risikoscore) und hat ein gutes Sicherheitsprofil ohne neue Signale. Diese Studiendaten könnten die Kombination zu einem neuen Standard in der Behandlung des r/r FL machen – insbesondere bei schwer behandelbaren Hochrisikopatient:innen. Von der FDA wurde diese Kombination kürzlich zugelassen, eine EMA-Zulassung wird bis Ende 2025 erwartet.7
CAR-T-Zellen: Tumormikroumgebung als Responseprädiktor
Große Beachtung fand eine Studie zur besseren Vorhersage des Ansprechens auf CAR-T-Zell-Therapien. Russler-Germain D et al. entwickelten dafür eine Einteilung der Tumormikroumgebung in drei verschiedene Archetypen (LymphoMaps). Die Einteilung basiert auf der Analyse von 227 Lymphknotenbiopsien mittels Single-Cell- und Bulk-RNA-Sequencing von Patient:innen mit diffusem großzelligem B-Zell-Lymphom (DLBCL), die entweder in der Erstlinie eine Standard-Chemoimmuntherapie erhalten hatten, oder Patient:innen mit einem Rezidiv, die in der Studie ZUMA-7 mit Axicabtagen-Ciloleucel (Axi-cel) behandelt worden waren:
-
Lymph Node (LN): Dieser Archetyp enthält sehr viele aktive CD4-T-Zellen.
-
T-exhausted (TEX): In diesem Archetyp fanden sich viele erschöpfte CAR-T-Zellen.
-
Fibroblast/Makrophage (FMAC): Dieser Archetyp ist charakterisiert durch viele Fibroblasten und Makrophagen.
Bei der ZUMA-7-Population war das Ereignis-freie Überleben (EFS) bei den mit Axi-cel behandelten Patient:innen und LN-Archetyp mit 67,3% signifikant höher als bei jenen mit den beiden anderen Archetypen (FMAC: 43,1%: TEX: 35,5%). Im Gegensatz dazu spielte der Archetyp unter der Chemoimmuntherapie in der Erstlinie beim progressionsfreien Überleben (PFS) keine Rolle (LN: 74,8%; TEX: 77,8%; FMAC: 65,8%).
Möglicherweise kann künftig anhand von Lymphknotenbiopsien prognostiziert werden, welche Patient:innen von einer CAR-T-Zell-Therapie profitieren.8
Tandem-CAR-T-Zell-Therapien anteportas
Bei rund 30% der CAR-T-Zellen ist ein Antigen-Verlust nach einer CD19-CAR-T-Zell-Therapie zu beobachten, vor allem nach einer vorangegangenen Immuntherapie. Mit den in der klinischen Entwicklung befindlichen CD19/CD20-CAR-T-Zell-Therapien sollen Resistenzen aufgrund von Antigen-Verlust vermieden werden. Bei der ICML wurden hierzu einige CD19/CD20-CAR-T-Zell-Kandidaten – z.B. KITE-363, JNJ-90014496, GLPG5101 und LYL314 – vorgestellt, darunter auch pragmatische Therapieansätze wie jene mit dem CD19/CD20-CAR-T-Zell-Präparat Zamtocabtagen autoleucel (Zamto-cel). Die CAR-T-Zellen werden mit CliniMACS Prodigy, einem automatisierten Zellverarbeitungsgerät für die effiziente Produktion GMP-konformer Zell- und Gentherapien, hergestellt. Dies ermöglicht eine kurze „Vene-zu-Vene-Zeit“ von 12–14 Tagen, sodass die CAR-T-Zellen frisch verabreicht werden können und nicht kryokonserviert werden müssen. Zamto-cel wird derzeit in einem Studienprogramm bei Patient:innen mit diffusem großzelligem B-Zell-Lymphom (DLBCL) untersucht.
Quelle:
18. International Conference on Malignant Lymphoma (ICML) vom 17.–21. Juni 2025 in Lugano
Literatur:
1 Sancho JM et al.: Polatuzumab vedotin, rituximab, gemcitabine and oxaliplatin (Pola-R-GemOx) for relapsed/refractory (R/R) diffuse large B-cell lymphoma (DLBCL): phase III POLARGO trial. ICML 2025; Oral Session 007 2 Abramson JS et al.: Glofitamab plus gemcitabine and oxaliplatin (Glofit-GemOx) in patients with relapsed/refractory (R/R) diffuse large B-cell lymphoma (DLBCL): 2-year follow-up of STARGLO. ICML 2025; Oral Session 076 3 Westin J et al.: Mosunetuzumab plus polatuzumab vedotin is superior to R-GemOx in transplant-ineligible patients with R/R LBCL: primary results of the phase III SUNMO trial. ICML 2025; Oral Session LBA3 4 Wurm-Kuczera R et al.: R-Pola-Glo – Chemo-light frontline therapy induces high response rates with a favorable safety profile in elderly/frail patients with aggressive lymphoma. ICML 2025; Abstr. #159 5 Belada D et al.: EPCORE DLBCL-3: fixed-duration epcoritamab monotherapy in older (≥75 y), anthracycline-ineligible patients with previously untreated large B-cell lymphoma (LBCL). ICML 2025; Abstr. #158 6 Falchi L et al.: Mosunetuzumab (mosun) produces durable benefit in patients (pts) with newly diagnosed follicular lymphoma (FL): extended follow up of the MITHIC-FL1 trial. ICML 2025; Oral Session 027 7 Sehn L et al.: Outcomes from the phase 3 inMIND study of tafasitamab (Tafa) plus lenalidomide (Len) and rituximab (R) for patients with relapsed/refractory follicular lymphoma (R/R FL). ICML 2025; Oral Session 028 8 Russler-Germain D et al.: Large B-cell lymphoma microenvironment archetype profiles (LymphoMAPs) identify subgroups with greatest benefit from CD19 CAR T-cell therapy. ICML 2025; Abstr. #005
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...