Hat die Sentinellymphknotenbiopsie ausgedient?
Autorin:
DDr. Kerstin Wimmer
Universitätsklinik für Allgemeinchirurgie Wien
E-Mail: kerstin.wimmer@meduniwien.ac.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Axillachirurgie befindet sich im Wandel. Während bis in die 1990er-Jahre die axilläre Dissektion als Standardverfahren galt1 – allerdings mit Lymphödemraten von bis zu 25% im betroffenen Arm2 –, hat sich die chirurgische Praxis in den letzten Jahrzehnten grundlegend verändert. Heute können wir bei ausgewählten Brustkrebspatientinnen sogar ganz auf die Entfernung des Sentinellymphknotens verzichten. Im folgenden Artikel wird erläutert, für welche Patientinnen diese neue Strategie infrage kommt und welche Kriterien dabei entscheidend sind.
Noch bis in die frühen 1990er-Jahre war die axilläre Dissektion (AD) fester Bestandteil der chirurgischen Therapie des Mammakarzinoms.1 Die Vorreiter der Sentinellymphknotenbiopsie waren allerdings nicht die Brustchirurg:innen, sondern die Dermatolog:innen bei der Therapie des Melanoms.3 Zunächst wurde mit kolloidalem Gold und später mit Patentblau versucht, den ersten Lymphknoten der Lymphabflussbahn – den sogenannten Wächterlymphknoten – zu identifizieren. Diese Technik wurde von Armando Giuliano für das frühe Mammakarzinom adaptiert und er bestätigte, dass das Auffinden des Sentinels auch beim Mammakarzinom möglich ist und einer geeigneten Staging-Methode der Axilla entspricht.4 Bereits wenige Jahre später zeigten erste Studien, dass die Entfernung des Sentinellymphknotens bei klinisch nodal-negativer Axilla und geplanter brusterhaltender Operation der axillären Dissektion nicht unterlegen ist.5–7 Im angloamerikanischen Raum etablierte sich der Begriff Sentinellymphknotenbiopsie (SLNB), der allerdings nicht mit einer diagnostischen (Feinnadel-)Biopsie verwechselt werden darf, sondern die chirurgische Entfernung des Wächterlymphknotens im Rahmen der Brustoperation bezeichnet. Im weiteren Verlauf dieses Artikels wird der Begriff SLNB entsprechend verwendet. In der Folge zeigte sich, dass bei klinisch nodal-negativer Axilla nicht nur auf die axilläre Dissektion verzichtet werden kann, sondern sogar dann, wenn der Sentinellymphknoten im endgültigen Operationspräparat doch tumorinfiltriert ist. Hier hat die Strahlentherapie der Lymphabflusswege zunehmend an Bedeutung gewonnen.8,9 Aktuelle Daten belegen, dass in einem bestimmten Niedrigrisikokollektiv sogar auf die Sentinellymphknotenbiopsie als Staging-Methode verzichtet werden kann. Dies wurde in den Studien INSEMA und SOUND untersucht, die beide die Frage behandelten, ob eine Deeskalation bei Patientinnen mit T1- bis T2-Tumoren und klinisch nodal-negativer Axilla sowie geplanter brusterhaltender Operation möglich ist.
INSEMA-Studie
In die INSEMA-Studie10 wurden 5502 Patientinnen ab 18 Jahren eingeschlossen, die ein T1- oder T2-Mammakarzinom mit klinisch und bildgebend unauffälliger Axilla aufwiesen. Die Patientinnen erhielten eine brusterhaltende Operation und wurden im Rahmen dessen im Verhältnis von 1:4 zur zusätzlichen Durchführung einer Sentinellymphknotenbiopsie oder zum Weglassen derselbigen randomisiert. Die „Per-Protocol-Population“ umfasste insgesamt 4858 Patientinnen, von denen 3896 eine SLNB erhielten, während bei 962 Patientinnen auf die SLNB verzichtet wurde. Die Mehrheit (89%) war 50 Jahre oder älter. Klinisch lag bei 90% ein T1-Tumor vor, der sich in 79% auch im Operationspräparat bestätigte. 95% aller Patientinnen hatten ein Hormonrezeptor-positives, HER2-negatives Karzinom, und 96% wiesen ein gut bis mäßig differenziertes (G1/G2) Tumorgrading auf. Bei 87% betrug der Ki-67-Wert ≤20%, und 73% hatten ein invasives Karzinom ohne besondere Typisierung (NST). In der SLNB-Gruppe fanden sich im Sentinelpräparat bei 3,5% Mikrometastasen, bei 11,6% ein makroskopischer Tumorbefall, wobei der Großteil eine pN1-Metastasierung darstellte (pN1: 11,4%, pN2: 0,2%). Nach der Operation erhielten alle Patientinnen die im Studienprotokoll vorgesehene Ganzbrustbestrahlung (WBI; „whole breast irradiation“). Teilbrustbestrahlung, hohe Tangenten oder eine nodale Strahlentherapie (außer bei ≥4 positiven Lymphknoten) waren nicht vorgesehen. Auch das inzwischen als Goldstandard etablierte moderate Hypofraktonierungs-Schema des „Fast-Forward“-Trials11 war nicht Teil des Protokolls. Obwohl nodale Strahlentherapie laut Protokoll nicht erlaubt war, fand sich im Studiensupplement interessanterweise, dass bei einem nicht unerheblichen Teil der Patientinnen nodale Regionen dennoch eine signifikante Strahlendosis abbekamen: Im Level I erhielten 50% der Patientinnen im Mittel ≥85% der Verschreibungsdosis und 25% sogar ≥95%. Nach einer medianen Nachbeobachtungszeit von rund 74 Monaten zeigte sich, dass das 5-Jahres-Überleben ohne invasives Rezidiv in beiden Gruppen nahezu identisch war (91,9% ohne SLNB vs. 91,7% mit SLNB). Das Risiko für ein Wiederauftreten unterschied sich statistisch nicht signifikant (HR: 0,91; 95% CI: 0,73–1,14) und lag unter der vordefinierten Grenze für Nichtunterlegenheit. Das Weglassen der SLNB ist somit in dieser Niedrigrisikopopulation der SLNB nicht unterlegen.
SOUND-Studie
Die SOUND-Studie12 schloss 1463 Patientinnen aller Altersgruppen mit einem Mammakarzinom bis maximal 2cm (cT1) ein. Auch hier durften sonografisch keine auffälligen Lymphknoten nachweisbar sein, und alle Patientinnen mussten sich einer brusterhaltenden Operation mit anschließender adjuvanter Radiotherapie unterziehen. In der „Per-Protocol-Population“ erhielten die Patientinnen im 1:1-Verhältnis entweder eine SLNB (n=708) oder es wurde darauf verzichtet (n=697). Auch hier zeigte sich eine Niedrigrisikokohorte: 81% der Patientinnen waren über 50 Jahre alt, 37% sogar über 65, und 79% postmenopausal. 88% wiesen ein Hormonrezeptor-positives, HER2-negatives Karzinom auf, 82% hatten ein G1- oder G2-Tumorgrading, und 64% zeigten einen Ki-67-Wert ≤20%. In der SLNB-Gruppe waren 14% der Lymphknoten metastatisch befallen, davon 5% Mikrometastasen, 8% pN1 und 1% pN2. Das Studienprotokoll erlaubte entweder eine Ganzbrust- oder Teilbrustbestrahlung, wobei über 80% eine Ganzbrustbestrahlung erhielten und Patientinnen mit Teilbrustbestrahlung unterrepräsentiert waren. Zusätzlich fehlten zum Teil konkrete Angaben zu Feldkonfigurationen oder zur Strahlendosis in nodalen Regionen. Nach einer medianen Nachbeobachtungszeit von 68,4 Monaten zeigte sich auch in dieser Studienpopulation kein signifikanter Unterschied in der lokoregionären Rezidivrate (1,7% vs. 1,6%) oder im 5-Jahres-Fernmetastasen-freien Überleben (97,7% vs. 98,0%, p=0,67). Somit bestätigte auch die SOUND-Studie die Möglichkeit, bei ausgewählten Niedrigrisikopatientinnen sicher auf die SLNB zu verzichten. Die Ergebnisse weiterer Studien – etwa der niederländischen BOOG-2013-08 RCT (NCT02271828) und der koreanischen NAUTILUS-Studie (NCT04303715) – werden mit Spannung erwartet. Vermutlich werden diese die bisherigen Daten bestätigen.
Vor- und Nachteile
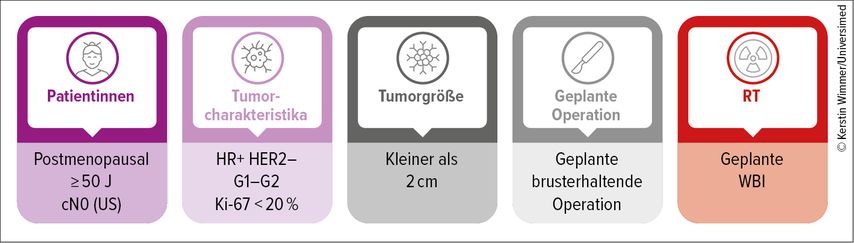
Die vorliegenden Studienergebnisse führten im Juni 2025 zu einer Aktualisierung der ASCO Clinical Practice Guidelines zur Sentinellymphknotenbiopsie bei frühem Mammakarzinom.13 Auch die Austrian Breast and Colorectal Cancer Study Group (ABCSG) hat im Juli dieses Jahres in der Rubrik Clinical Opinions ihre „Guidance zum Verzicht auf die Sentinel-Node-Biopsie“ veröffentlicht.14 Dort finden sich eine fundierte Analyse der vorhandenen Daten sowie eine Einschätzung von Expert:innen. Zusammenfassend lässt sich sagen, dass bei postmenopausalen Patientinnen ab 50 Jahren mit Tumoren unter 2cm (cT1), klinisch und sonografisch unauffälliger Axilla, duktalem, Hormonrezeptor-positivem, HER2-negativem Mammakarzinom ohne Multizentrizität oder -fokalität, einem Grading von G1–G2 sowie einem Ki-67-Wert unter 20% (Abb. 1) auf die SLNB verzichtet werden kann. Aufgrund der jeweiligen Einschlusskriterien der Studien SOUND und INSEMA beziehen sich die Ergebnisse allerdings ausschließlich auf weibliche Patientinnen. Entsprechend ist die Empfehlung zum Verzicht auf die Sentinellymphknotenbiopsie in den ASCO-Leitlinien auf diese Patientengruppe beschränkt und gilt nicht für männliche Patienten.13
Abb. 1: Deeskalationskriterien für den Verzicht auf die Sentinellymphknotenbiopsie (SLNB) bei Patientinnen mit frühem Mammakarzinom
Dennoch stellt sich die Frage, welche wichtigen Informationen für die weitere Therapieentscheidung durch den Verzicht auf die SLNB verloren gehen. Besonders bemerkenswert ist der hohe Anteil an Patientinnen, die eine adjuvante Chemotherapie erhielten – nicht nur in den SLNB-Gruppen (INSEMA: 12%, SOUND: 20,1%), sondern auch in den Non-SLNB-Gruppen (INSEMA: 10%, SOUND: 17,5%). Hilfsmittel wie der EPClin-Risiko-Score15 sowie der kostenfreie Online-Risikoscore CTS5 ( https://cts5-calculator.com ), der das Risiko einer Fernmetastasierung nach fünf Jahren adjuvanter endokriner Therapie vorhersagt,16 benötigen ebenfalls Informationen aus den Lymphknoten, um eine verlässliche Prognose zu erstellen. Eine weitere wichtige Fragestellung betrifft die Indikation zur Behandlung mit CDK4/6-Inhibitoren. Obwohl in der SLNB-Gruppe der INSEMA-Studie acht Patientinnen (0,2%) vier oder mehr positive Lymphknoten aufwiesen, besteht für die Indikation von Abemaciclib17 nahezu keine Überschneidung mit den Charakteristika der Niedrigrisikopatientinnen der INSEMA- und SOUND-Studien. Für Ribociclib18 hingegen bestehen Bedenken: Wanis et al. analysierten Patientinnen der National Cancer Data Base aus den Jahren 2018 bis 2020. Eingeschlossen wurden 119312 Patientinnen mit cT1cN0, Hormonrezeptor-positivem Mammakarzinom, die eine brusterhaltende Operation mit SLNB erhielten. Es zeigte sich, dass 7,5% der Patientinnen allein aufgrund der Information des Sentinelstatus die Indikation für Ribociclib erhielten.19 Dieser Anteil sollte nicht unterschätzt werden, da diese Patientinnen ansonsten möglicherweise unterbehandelt würden. Um Patientinnen, die von einem signifikanten Vorteil im 4-Jahres-invasiven-krankheitsfreien Überleben von nahezu 5% durch die Erweiterung der adjuvanten Therapie mit Ribociclib profitieren könnten,18 nicht auszuschließen, sollte bei jeglicher Verschlechterung von relevanten Tumormerkmalen (z.B. höheres Grading, erhöhter Ki-67-Wert, Lymphangiosis) im Resektionspräparat eine nachträgliche Sentinellymphknotenbiopsie in Erwägung gezogen werden. Darüber hinaus zeigen die Daten aus den SOUND- und INSEMA-Studien, dass in etwa 11–13% der Fälle ein positiver Lymphknoten in der SLNB-Gruppe nachgewiesen wurde. Dies bedeutet, dass bei Verzicht auf die SLNB diese positiven Befunde bei einem nicht unerheblichen Teil der Patientinnen unentdeckt bleiben könnten, was Auswirkungen auf die adjuvante Therapie und somit auf das Behandlungsergebnis haben kann.
Fazit
Abschließend ist hervorzuheben, dass basierend auf der aktuellen Datenlage eine Deeskalation der Bestrahlungstherapie derzeit nicht empfohlen werden kann. In beiden Studien wurde konsequent die Ganzbrustbestrahlung angewendet (INSEMA: 100%, SOUND: >80%), wodurch die Übertragbarkeit der Ergebnisse auf alternative Bestrahlungsschemata, wie das hypofraktionierte „Fast-Forward“-Schema, Teilbrustbestrahlung oder einen vollständigen Verzicht auf die Radiotherapie in ausgewählten Niedrigrisikopopulationen, derzeit nicht gesichert ist. Eine solche Modifikation der Therapie muss sorgfältig mit der Patientin abgestimmt und unter Berücksichtigung individueller Risikofaktoren diskutiert werden. Obgleich eine chirurgische Deeskalation wünschenswert ist, sollte diese nicht durch eine Eskalation der Strahlentherapie kompensiert werden. Andererseits erscheint eine gleichzeitige Deeskalation beider Therapiekomponenten aktuell nicht ratsam, da die onkologische Sicherheit weiterhin oberste Priorität besitzt.
Literatur:
1 Cabanes PA et al.: Value of axillary dissection in addition to lumpectomy and radiotherapy in early breast cancer. The Breast Carcinoma Collaborative Group of the Institut Curie. Lancet 1992; 339(8804): 1245-8 2 Petrek JA et al.: Lymphedema in a cohort of breast carcinoma survivors 20 years after diagnosis. Cancer 2001; 92(6): 1368-77 3 Morton DL et al.: Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg 1992; 127(4): 392-9 4 Giuliano AE et al.: Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Ann Surg 1994; 220(3): 391-8; discussion 398-401 5 Veronesi U et al.: Sentinel lymph node biopsy and axillary dissection in breast cancer: results in a large series. J Natl Cancer Inst 1999; 91(4): 368-73 6 Mansel RE et al.: Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC trial. J Natl Cancer Inst 2006; 98(9): 599-609 7 Krag DN et al.: Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial. Lancet Oncol 2010; 11(10): 927-33 8 Donker M et al.: Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial. Lancet Oncol 2014; 15(12): 1303-10 9 Giuliano AE et al.: Effect of axillary dissection vs no axillary dissection on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis: the ACOSOG Z0011 (Alliance) randomized clinical trial. Jama 2017; 318(10): 918-26 10 Reimer T et al.: Axillary surgery in breast cancer - primary results of the INSEMA trial. N Engl J Med 2025; 392(11): 1051-64 11 Murray Brunt A et al.: Hypofractionated breast radiotherapy for 1 week versus 3 weeks (FAST-Forward): 5-year efficacy and late normal tissue effects results from a multicentre, non-inferiority, randomised, phase 3 trial. The Lancet 2020; 395(10237): 1613-26 12 Gentilini OD et al.: Sentinel lymph node biopsy vs no axillary surgery in patients with small breast cancer and negative results on ultrasonography of axillary lymph nodes: the SOUND randomized clinical trial. JAMA Oncol 2023; 9(11): 1557-64 13 Park KU et al.: Sentinel lymph node biopsy in early-stage breast cancer: ASCO Guideline Update. J Clin Oncol 2025; 43(14): 1720-41 14 https://www.abcsg.org/veroeffentlichungen/abcsg-clinical-opinions/ 15 Filipits M et al.: A new molecular predictor of distant recurrence in ER-positive, HER2-negative breast cancer adds independent information to conventional clinical risk factors. Clin Cancer Res 2011; 17(18): 6012-20 16 Dowsett M et al.: Integration of clinical variables for the prediction of late distant recurrence in patients with estrogen receptor-positive breast cancer treated with 5 years of endocrine therapy: CTS5. J Clin Oncol 2018; 36(19): 1941-8 17 Johnston SRD et al.: Abemaciclib combined with endocrine therapy for the adjuvant treatment of HR+, HER2-, node-positive, high-risk, early breast cancer (monarchE). J Clin Oncol 2020; 38(34): 3987-98 18 Fasching PA et al.: Ribociclib plus endocrine therapy in hormone receptor-positive/ERBB2-negative early breast cancer: 4-year outcomes from the NATALEE randomized clinical trial. JAMA Oncol 2025; e253700 19 Wanis KN et al.: Implications of omitting sentinel lymph node biopsy on adjuvant decision making for patients with small breast cancers. Cancer 2025; 131(11): e35910
Das könnte Sie auch interessieren:
Unser Universimed-Team berichtet für Sie aus Salzburg!
Die Jahrestagung der OEGGG findet in diesem Jahr vom 30. Mai bis 2. Juni in Salzburg statt. Diese Veranstaltung ist zweifelsohne eine der bedeutendsten Tagungen für Gynäkologinnen und ...
OeGGG 2018
...
OeGGG 2018
Test...